Verouderen blijft niet zonder gevolgen. Discuscellen moeten snel hun strategie aanpassen.
Voorwoord
Veroudering is een onomkeerbaar en niet te stoppen scheikundig proces. Kijk maar naar foto’s van uzelf of familieleden door de jaren heen. De maskerende anti-agingindustrie viert hoogtij, maar kan niets veranderen aan de duizenden chemische reacties die zich in onze miljarden lichaamscellen op ieder ogenblik voltrekken. Cellen verliezen geleidelijk aan de mogelijkheid om water aan te maken (water = H2O = verbinding tussen twee atomen waterstof en één atoom zuurstof). Verouderen wordt dan in de eerste plaats gekenmerkt door gestaag verlies van cellulair water. Dit verlies heeft uiteraard ook invloed op de aanmaak en afbraak van andere scheikundige bestanddelen in en rondom de cellen. In de kraakbeengewrichten zoals knie, heup en discus onderzocht men deze invloed vooral op collagene eiwitten en suikereiwitten (= proteoglycanen).
Niet alle kraakbeencellen in ons lichaam verouderen even snel
In discussen van de onderrug veroudert het kraakbeen veel sneller dan in gewrichten van armen en onderbenen. Men kent de precieze mechanismen (nog) niet, maar kraakbeencellen in armen en benen zijn veel langer in staat hun geproduceerde hoeveelheid water op peil te houden. Hierdoor kunnen gewrichten zoals heup en knie veel langer grotere weerstand bieden tegen het ontstaan van dagelijkse microscopische overbelastingletseltjes(1a, 1b) (cf. Blog ‘Artrose in armen en benen'. Wat we allemaal eigenlijk zouden moeten weten…’). Ook in nekdiscussen treden ouderdomsfenomenen veel minder prominent en veel later op dan in onderrugdiscussen. Omdat de nek slechts het totale gewicht van het hoofd draagt maar anderzijds veel beweeglijker is dan de onderrug, is het hydraulisch functiemechanisme van nekdiscussen minder goed ontwikkeld (cf. Blog ‘Functie van discussen in de lage rug’). Daarom ook produceren cellen in de kernen van nekdiscussen tijdens hun ontwikkeling veel minder suikereiwitten (om water vast te houden) en veel meer fijne type 2 elastische collagene vezeltjes (1c) (Fig. 1). Toch zorgen de verouderingsprocessen dat alle kraakbenige structuren in het lichaam verouderen en daardoor stijver, zwakker en kwetsbaarder worden.

Fig. 1. Midsagittale doorsnede van de zes wervellichamen (C2 t. e. m. C7) en hun vijf cervicale discussen (C2-C3 t. e. m. C6-C7) in de nekwervelzuil van een 9-jarige jongen (X89-1170 / Declerck - Kakulas, Neuropathology, Perth, Western Australia). In tegenstelling tot de discussen in de onderrug vertonen de kernen van bijna alle nekdiscussen een veel minder uitgesproken doorzichtig waterig voorkomen. Hier is dit zeer goed zichtbaar t. h. v. de C2-C3, C3-C4 en C4-C5 cervicale discussen. De cellen in de nekdiscuskernen produceren veel minder suikereiwitten, waardoor er minder water aanwezig is. T. h. v. de C5-C6 en C6-C7 discussen blijft de gelatineuze waterige kern duidelijker. De meeste bewegingen in de nek gebeuren ook t. h. v. van deze onderste nekdiscussen. Dit is dan ook de vermoedelijke reden waarom de meeste discogene problemen in de nek op deze plaatsen voorkomen.
Discussen in de onderrug verouderen vanaf 20 jaar!
Op 20-jarige leeftijd zijn de zogenaamde notochordale cellen uit de discuskernen in de onderrug verdwenen. Indien ze langer zouden overleven, zou het hoog watergehalte behouden blijven en vroegtijdige veroudering en slijtage tot een later tijdstip uitgesteld worden (Fig. 2) (cf. Blog ‘Discussen in de onderrug verouderen snel’). Omdat de buitenste omringende vezelringen in toenemende mate de dagelijkse inwerkende compressiekrachten moeten helpen opvangen, resulteert deze verouderingsevolutie in een toenemende maar strikt normale uitpuiling (= bulging) van de discussen (2, 3, 4, 5, 6). Om toch nog weerstand te kunnen bieden (cf. Blog ‘Functie van discussen in de lage rug'), versterkt de natuur dan zowel de kern, de buitenring als eindplaten. Als deze versteviging niet plaats zou vinden, zouden onze wervelzuilen als kaartenhuisjes in elkaar zakken. Spijtig genoeg bestaan er nog geen specifieke organische materialen om de veroudering en aftakeling van discuskernen te vermijden. Er bestaat m. a. w. nog geen efficiënte therapie om deze verouderingsevolutie te stabiliseren en lage rugpijn te voorkomen.
Discuskernen in de onderrug worden steeds kwetsbaarder
De mechanische eigenschappen van discuskernen in de onderrug hangen af van de hoeveelheid, de organisatie en de specifieke eigenschappen van hun scheikundige componenten. Omdat de notochordale cellen slechts tijdens de adolescentie overleven en er daardoor achteraf veel minder suikereiwitten geproduceerd worden, krijgen de kernen het functioneel moeilijker (7, 8, 9, 10, 11, 12, 13, 14). De kernen bevatten steeds minder water. Hun hydrostatische druk vermindert (2, 3, 7), wat op zijn beurt ook een verminderde productie van suikereiwitten in de hand werkt (15). Zolang er echter nog voldoende afbraakfragmenten van suikereiwitten opgeslagen blijven, spelen de kernen nog een belangrijke rol in de hydraulische functie van discussen (16). Wel zullen bij de meesten onder ons de onderste discuskernen tussen de 4 de en 5 de lumbale wervels en de 1 ste sacrale wervels de meest kwetsbare blijven (Fig. 3).
Discuscellen kunnen niet anders dan hun strategie aanpassen
Omdat de notochordale cellen vroegtijdig sterven en hierdoor de hoeveelheid suikereiwitten en water geleidelijk aan vermindert, zullen in de discuskernen de elastische collageenvezeltjes (type 2) ook meer en meer op elkaar geperst, vervormd en afgebroken worden(17). Om de discusfuncties dan toch zo lang mogelijk te vrijwaren, hebben de resterende kraakbeencellen geen andere keuze dan hun strategie aan te passen. Om de discuskernen te versterken, produceren ze veel meer dikkere, taaiere en minder rekbare (type 1) collagene vezels (17, 18, 19, 20, 21). Hierdoor zal de kern steeds meer lijken op stijver littekenweefsel waardoor de grens tussen kern en omringende vezelring vervaagt (22, 23). In zeer jonge en gezonde discussen is die grens overduidelijk. Naarmate de kern veroudert, lijkt hij steeds beter op zijn veel sterkere omgevende buitenring (24) (Fig. 2 en Fig. 3).
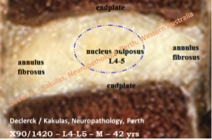
Fig. 2. Ondanks een bijzonder zwaar rugbelastend beroep ervaarde deze 42-jarige man nooit lage rugpijn. De L4-L5 discus vertoont slechts minimale verouderingstekenen waardoor de kern (nucleus pulposus) nog steeds zijn jonge witte kleur behouden heeft. De kern is arm aan water, heeft zijn doorzichtig gelatineus voorkomen verloren en lijkt meer op littekenweefsel. De grens tussen de kern en de omgevende buitenring (annulus fibrosus) is niet langer scherp afgelijnd. Kern en buitenring lijken reeds sterk op elkaar. De hoogte van de discus is bewaard, wat er duidelijk op wijst dat er nog geen slijtageslag is opgetreden (lees volgende blog). Er zijn (nog) geen scheuren of fissuren te zien (A90-1420 / Declerck - Kakulas, Neuropathology, Perth, Western Australia).
De discuskernen lijken steeds meer op littekenweefsel
Naarmate ze ouder worden, lijken discuskernen steeds meer op bindweefsel zoals aangetroffen in littekenweefsel (25, 26) (Fig. 2 en Fig. 3). De kernen worden hierdoor droger, minder elastisch en ook mechanisch stijver (27, 28, 29, 30). Omdat littekenweefsel normaal geen pijngevoelige zenuwvezeltjes bevat, is deze fase in de verouderingsevolutie van de discuskern niet pijnlijk.
Dit belangrijk evoluerend gegeven is de reden waarom men blijft zoeken naar innovatieve en efficiënte biologische behandelingen voor lage rugpijn. Bij sommige proefdieren is men er reeds in geslaagd bepaalde stamcellen tot littekenvormende cellen om te vormen (= fibroblasten), ze in discuskernen te injecteren en discussen volledig tot littekenweefsel om te toveren. Mocht men bij de mens dezelfde eindresultaten bekomen (31), dan zou men reeds op veel jongere leeftijd de natuurlijke evolutie van onze discussen kunnen nabootsen vooraleer de pijnlijke degeneratieve processen optreden en de discushoogte vermindert (Fig. 3). De natuur zorgt er nu eenmaal voor dat al onze discussen spontaan tot (ouderdoms)littekenweefsel omgevormd worden. Het probleem is dat het veel te lang duurt! In volgende blogs wordt het mogelijke belang van het vroegtijdig kunnen nabootsen van deze natuurlijke discogene evolutie nog duidelijker illustratief voorgesteld.
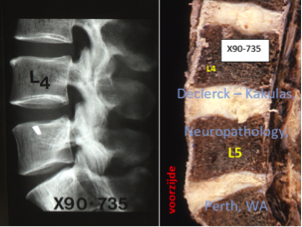
Illustratie van beginnende discogene degeneratieslag in de verouderende L5-S1 discus bij een 38-jarige man die af en toe lage rugpijnopstoten ervaarde. Tijdens het verouderingsproces ondergaat de discusstructuur in de onderrug drastische veranderingen. De waterinhoud in de kern vermindert en er is een toenemende productie van veel minder elastische maar veel taaiere (type 1) collageenvezels. Het doorzichtige gelatineuze voorkomen van de kern verdwijnt. De discussen lijken steeds meer op wit littekenweefsel. Men kan t. h. v. de L3-L4 en L4-L5 discussen nog vrij goed zien waar de kernen zich min of meer centraal bevonden alhoewel de grenzen tussen kern en buitenste vezelring bijna verdwenen zijn. De hoogten van deze discussen zijn nog niet afgenomen, wat er op wijst dat er nog geen vergevorderde degeneratieve processen zijn opgetreden. T. h. v. de onderste discus L5-S1 is de situatie compleet anders. De locatie van de kern is niet meer vast te stellen. De kleur van de discus is eerder bruingeel wat op veroudering wijst. De discushoogte is ook duidelijk afgenomen, wat aangeeft dat de degeneratieslag reeds vergevorderd is. Men merkt trouwens de aanwezigheid van fissuren. Of de buitenste vezelring reeds scheuren vertoonde, werd (spijtig genoeg) niet nagegaan. Maar de structuur is duidelijk verschillend achteraan ten opzichte van vooraan (X90-735, M, 38 yrs / Declerck – Kakulas, Neuropathology, Perth, Western Australia).
Metamorfose van kernen beïnvloedt beide andere discusstructuren
De vroeg optredende metamorfose van de initieel halfvloeibare, structuurloze en doorzichtige geleiachtige discuskern naar een stijve littekenachtige structuur (32, 33) heeft drastische gevolgen voor beide andere discusonderdelen. Omdat het verouderingsproces in de kernen onophoudelijk vooruitschrijdt, komen de eindplaten en de vezelring steeds meer onder druk te staan waardoor ze makkelijker kunnen breken of scheuren (34).
Eerst treedt er versterking op in de eindplaten
Normaal zal de natuur eerst de eindplaten versterken (8). Nadat er meer taaiere (type 1) collageenvezels geproduceerd werden, zullen de eindplaten verkalken en verbenen, waardoor ze hun buigzame elasticiteit verliezen. Toch blijven eindplaten de zwakste schakels in de discussen en vormen hun fissuren of breuken de belangrijkste verklaring voor de optredende pijnopstoten in de onderrug (cf. Blog ‘Lage rugpijn bij jonge mensen. Eindplaten zijn de belangrijkste pijnbron’).
Ook de buitenste vezelringen worden versterkt
De verouderingsprocessen hebben minder snel vat op de buitenste vezelringen (35, 36). Vanaf het ogenblik dat ze verplicht worden mee te werken om de dagelijkse compressieve lasten te dragen, moeten ze weliswaar ook sterker en stijver worden (37). Om de kernen zo lang mogelijk af te schermen, zorgt de natuur ervoor dat deze reeds zeer sterke buitenvestingen nog sterker worden om pijnlijke scheuren te voorkomen. Daarom worden er vooral in hun binnenste en middelste derden meer taaiere collageenvezels aangemaakt (22, 38, 39, 40, 41). Treden er toch scheuren op dan kunnen ze zich doorheen de volledige vezelring propageren (42) en lage rugpijn doen ontstaan.
Uiteindelijk lijdt de volledige discus onder het verouderingsproces
Verouderende en uitdrogende discuskernen verliezen hun typische onsamendrukbaarheid(43, 44, 45), wat een groot risico inhoudt. Omdat ze verplicht worden de dagelijkse rugbelastingen op te vangen, moet er steeds meer beroep gedaan worden op de omringende sterkere vezelringen (46, 47). Maar omdat de discussen steeds meer op littekenweefsel lijken en dus veel minder elastisch worden, veroorzaakt de toenemende stress in de vezelringen een groot probleem.
Ook voor de discus blijft mechanische stress blijft belastend
Onder de dagelijkse mechanische stress zal ook in deze taaiere collagene vezels de druk toenemen (7, 43, 48). Ze worden moe en zullen daardoor ook minder weerstand blijven bieden (49). Initieel vormt dit geen probleem, maar de buitenste vezelringen die onder grote druk staan, gaan wel meer uitpuilen en vormen dus zichtbare (pijnloze) bulgings op MRI. Deze fenomenen doen zich vooral voor aan de achterzijde van de onderste twee discussen, omdat deze zones minder stijf zijn dan de gedeelten vooraan in de discus (zie L5-S1 discus op Fig. 3) (36, 49, 50, 51, 52). Onder de continu vervormende belastingskrachten zullen de achteraan gelegen collagene vezels meer uitgetrokken en beschadigd worden. Uiteindelijk bezwijken en scheuren de vezelringen (53). Wanneer deze defecten in elkaar overlopen leidt dit tot een cascade van grotere degeneratieve letsels (18, 19, 20, 53, 54, 55) die doorgaans niet meer kunnen genezen (53). Dit is de zeer waarschijnlijke hoofdreden voor de regelmatig pijnopstoten in de onderrug (meer hierover in volgende blogs). Maar rust roest en de discus zal verder eroderen. We hebben dus als rechtop lopend zoogdier geen andere keus dan de onderrug zo snel als mogelijk opnieuw te belasten en te bewegen wanneer er pijnopstoten optreden.
Bij de meesten onder ons (+/- 80 %) ligt deze geschetste verouderingsevolutie aan de basis van de ontwrichting van de discusfunctie (66) en het ontstaan van lage rugpijn. In ongeveer 20 % vormen ernstigere problemen de hoofdreden voor pijn in de onderrug (cf. Blog ‘Lage rugpijn: oorzaak slechts in 15 % à 20 % van de gevallen met zekerheid te bepalen’).
Vooral draaibewegingen veroorzaken discusscheuren
In laboratoria onderzocht men wat er in intacte discussen in de onderrug gebeurt wanneer we steeds meer en grotere draaibewegingen uitvoeren. Vooral de sterkere collagene vezels in de buitenste vezelring aan de achterzijde lijden hieronder. Ze worden steeds verder opgespannen, uitgerekt vooraleer ze scheuren (Fig. 4) (56, 57, 58). Deze ‘buitenste’ discusscheuren veroorzaken geen hernia’s, maar zijn wel de hoofdreden van lage rugpijn. Men zou kunnen aannemen dat de ontstane ‘buitenste’ scheuren zich ook naar binnen tot tegen de kern uitbreiden (overbelasting ‘out-to-in tears’) en zo een hernia zouden kunnen vormen. Maar hiervoor bestaat niet het minste wetenschappelijke bewijs (58).
De collagene vezels aan de binnenzijde van de vezelring die zich dus het dichtst bij de kern bevinden, bezwijken niet. De natuur zorgt er ook voor dat tijdens verouderingsprocessen vooral de binnenste zones versterkt worden (zie hoger) en daarom aan rekbaarheid inboeten (42). Dit is een vrij logische beschermingszet van de natuur. De kern van de discus in de onderrug moet tijdens de mogelijke latere optredende discusdegeneratie zo lang mogelijk op zijn plaats gehouden worden om geen hernia te vormen. Maar vanaf het ogenblik dat de discusdegeneratie goed vordert, ontstaan er wel scheuren in de binnenste zones. De discuskern kan er dan eventueel doorheen migreren (degeneratieve ‘in-to-out tears’) en een degeneratieve hernia vormen. In die omstandigheden ontstaat er een pijn in het onderbeen die veel intenser is dan de ervaren lage rugpijn. De problematiek rond discushernia’s wordt in latere blogs uitgelegd.
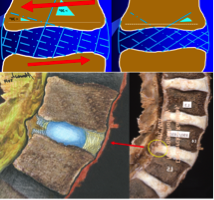
Fig. 4. De buitenste vezelring kan qua stevigheid vergeleken worden met een tuinomheining die uit een 20-tal dicht opeengepakte, rechtopstaande cilindervormige afrasteringen bestaat en waarbij de bedrading in elke afrastering in tegenovergestelde richting verloopt (Cf. Blog ‘Lage rugpijn bij jonge mensen. Rol van de kern en de buitenring tot 15 jaar’). Wanneer we rond onze lichaamsas draaien, worden alle vezels in dezelfde richting uitgerekt. Alle vezels die in de verschillende afrasteringen in horizontale richting zullen uitgerekt worden, kunnen door de ontstane spanning scheuren. In de andere afrasteringen worden de vezels in een meer verticale richting gedwongen en zal hun spanning verminderen. De rode pijlen in het bovenste gedeelte van deze schets geven de draairichting weer waarbij in labo-omstandigheden tijdens het draaien de richtingsverandering van de vezels nagegaan wordt. De vezels waarin de spanning het grootst is, zullen eerst bezwijken (schetsen bovenaan). Dit gebeurt vooral in de vezels die het verst verwijderd zijn van de discuskern (schetsen onderaan). Tijdens de draaibewegingen ontstaan de scheuren dus vooral aan de buitenzijde van de discus (Declerck / Kakulas, X89-1450, L4-L5, M, 22 yrs. Illustratieve schets door Alonso Ríos, Colombiaanse beeldhouwer, tekenaar en schilder - www.alonsoriosecultor.com).
Verstijving van de wervelzuil gaat niet altijd gepaard met pijn
We weten allemaal dat de beweeglijkheid van de wervelzuil bij de meesten onder ons zal afnemen naarmate we ouder worden. Buigen en strekken verminderen gemiddeld 20 % tussen de leeftijd van 20 en 55 jaar (59, 60, 61). Sagittale sectie en analyse van wervelzuilen na overlijden toont aan dat niet de spieren hiervoor verantwoordelijk zijn (62) (cf. Blog ‘Enkele weetjes over de lage rugspieren’). De bewegingsbeperkingen zijn nl. in hoofdzaak te wijten aan toenemende veroudering van de discusstructuren (63, 64). Toenemende bewegingsvermindering is echter niet noodzakelijk een slechte zaak. Naarmate de lage rug stijver wordt, nemen ook de chronische lage rugpijnklachten af (65).
De volgende blog bespreekt de radiologische veranderingen die discussen in de onderrug ondergaan tijdens de verouderingsprocessen.
Referenties
1a. Ferguson RJ, Palmer AJR, Taylor A et al., ‘Hip and knee replacement 1. Hip replacement’,
Lancet, 2018, 392:1662
1b. Price AJ, Alvand A, Troelsen A et al., ‘Hip and knee replacement 2. Knee replacement’,
Lancet, 2018, 392:1672
1c. Scott JE, Bosworth TR, Cribb AM, Taylor JR, ‘The chemical morphology of age-related changes in human intervertebral disc
glycosaminoglycans from cervical, thoracic and lumbar nucleus pulposus and annulus fibrosus’,
J Anat, 1994, 184:73
2. Adams MA, McNally DS, Dolan P, ‘'Stress' distributions inside intervertebral discs. The effects of age and degeneration’,
J Bone Joint Surg, 1996, 78B:965
3. Sato K, Kikuchi S, Yonezawa T, ‘In vivo intradiscal pressure measurement in healthy individuals and in patients with ongoing back
problems’,
Spine, 1999, 24:2468
4. Iatridis JC, Setton LA, Foster RJ et al., ‘Degeneration affects the anisotropic and nonlinear behaviors of human anulus fibrosus in
compression’,
J Biomech, 1998, 31:535
5. Iatridis JC, Kumar S, Foster RJ et al., ‘Shear mechanical properties of human lumbar annulus fibrosus’,
J Orthop Res, 1999, 17:732
6. O'Connell GD 1 , Guerin HL, Elliott DM, ‘Theoretical and uniaxial experimental evaluation of human annulus fibrosus degeneration’,
J Biomech Eng, 2009, 131:111007
7. Buckwalter JA, ‘Aging and degeneration of the human intervertebral disc’,
Spine, 1995, 20:1307
8. Boos N, Weissbach S, Rohrbach H et al., ‘Classification of age-related changes in lumbar intervertebral discs. 2002 Volvo Award in
basic science’,
Spine, 2002, 27:2631
9. Adams MA, Hutton WC, ‘The effect of posture on the fluid content of lumbar intervertebral discs’,
Spine, 1983, 8:665
10. Antoniou J, Steffen T, Nelson F et al., ‘The human lumbar intervertebral disc. Evidence for changes in the biosynthesis and
denaturation of the extracellular matrix with growth, maturation, ageing, and degeneration’,
J Clin Invest, 1996, 98:996
11. Urban JP, Roberts S, ‘Degeneration of the intervertebral disc’,
Arthritis Res Ther, 2003, 5:120
12. Gower WE, Pedrini V, ‘Age-related variations in proteinpolysaccharides from human nucleus pulposus, annulus fibrosus, and costal
cartilage’,
J Bone Joint Surg, 1969, 51A:1154
13. Kraemer J, Kolditz D, Gowin R, ‘Water and electrolyte content of human intervertebral discs under variable load’,
Spine, 1985, 10:69
14. Urban JP, McMullin JF, ‘Swelling pressure of the lumbar intervertebral discs. Influence of age, spinal level, composition, and
degeneration’,
Spine, 1988, 13:179
15. Ishihara H, McNally DS, Urban JP et al., ‘Effects of hydrostatic pressure on matrix synthesis in different regions of the intervertebral
disk’,
J Appl Physiol, 1996, 80:839
16. Roughley PJ, ‘Biology of intervertebral disc aging and degeneration. Involvement of the extracellular matrix’,
Spine, 2004, 29:2691
17. Singh K, Masuda K, Thonar EJMA et al., ‘Age-related changes in the extracellular matrix of nucleus pulposus and anulus fibrosus of
human intervertebral disc’,
Spine, 2009, 34:10
18. Bischop PB, Pearce RH, ‘The proteoglycans of the cartilaginous end-plate of the human intervertebral disc change after maturity’,
J Orthop Res, 1993, 11:324
19. Pokharna HK, Phillips FM, ‘Collagen crosslinks in human lumbar intervertebral disc aging’,
Spine, 1998, 23:1645
20. DeGroot J, Verzijl N, Wenting-van Wijk MJ et al., ‘Accumulation of advanced glycation end products as a molecular mechanism for
aging as a risk factor in osteoarthritis’,
Arthritis Rheum, 2004, 50:1207
21. Wagner DR, Reiser KM, Lotz JC, ‘Glycation increases human annulus fibrosus stiffness in both experimental measurements and
theoretical predictions’,
J Biomech, 2006, 39:1021
22. Coventry MB, Ghormley RK, Kernohan JW, ‘The intervertebral disc. Its microscopic anatomy and pathology. Part I. Anatomy,
development and physiology’,
J Bone Joint Surg, 1945, 27A:105
23. Vernon-Roberts B, Fazzalari NL, Manthey BA, ‘Pathogenesis of tears of the anulus investigated by multiple-level transaxial analysis of
T12-L1 disc’,
Spine, 1997, 22:2641
24. Sivan SS, Wachtel E, Tsitron E et al., ‘Collagen turnover in normal and degenerate human intervertebral discs as determined by the
racemization of aspartic acid’,
J Biol Chem, 2008, 283:8796
25. Thompson JP, Pearce RH, Schechter MT et al., ‘Preliminary evaluation of a scheme for grading the gross morphology of the human
intervertebral disc’,
Spine, 1990, 15:411
26. Vernon-Roberts B, ‘Age related and degenerative pathology of the intervertebral discs and apophyseal joints’,
In Jayson MIV (ed), ‘The lumbar spine and back pain’,
Churchill Livingstone, London, 1992, Vol 4:17
27. Adams MA, Dolan P, Hutton WC, ‘The stages of disc degeneration as revealed by discograms’,
J Bone Joint Surg, 1986, 68B:36
28. Umehara S, Tadano S, Abumi K et al., ‘Effects of degeneration on the elastic modulus distribution in the lumbar intervertebral disc’,
Spine, 1996, 21:811 and further discussion:820
29. Wagner DR, Reiser KM, Lotz JC, ‘Glycation increases human annulus fibrosus stiffness in both experimental measurements and
theoretical predictions’,
J Biomech, 2006, 39:1021
30. Haefeli M, Klaberer F, Saegesser D et al., ‘The course of macroscopic degeneration in the human lumbar intervertebral disc’,
Spine, 2006, 31:1522
31. www.guy-declerck.com / Degenerative discogenic syndrome / Therapeutic considerations
32. McDevitt CA, ‘Proteoglycans of intervertebral disc’, In: Ghosh P (ed), ‘The biology of the intervertebral disc’,
Florida, Boca Raton, CRC Press, 1988:151
33. Gruber HE, Hanley EN Jr, ’Analysis of aging and degeneration of the human intervertebral disc. Comparison of surgical specimens
with normal controls’,
Spine, 1998, 23:751
34. Cheung KM, Samartzis D, Karppinen J et al., ‘Intervertebral disc degeneration. New insights based on "skipped" level disc pathology’,
Arthritis Rheum, 2010, 62:2392
35. Acaroglu ER, Iatridis JC, Setton LA et al., ‘Degeneration and aging affect the tensile behavior of human lumbar anulus fibrosus’
Spine, 1995, 20:2690
36. Ebara S, Iatridis JC, Setton LA, et al., ‘Tensile properties of nondegenerate human lumbar anulus fibrosus’,
Spine, 1996, 21:452
37. Bank RA, Bayliss MT, Lafeber FP et al., ‘Ageing and zonal variation in post-translational modification of collagen in normal human
articular cartilage. The age-related increase in non-enzymatic glycation affects biomechanical properties of cartilage’,
Biochem J, 1998, 330:345
38. Hirsch C, Schajowicz F, ‘Studies on structural changes in the lumbar annulus fibrosus’,
Acta Orthop Scand, 1953, 22:184
39. Harris RI, MacNab I, ‘Structural changes in the lumbar intervertebral discs. Their relationship to low back pain and sciatica’,
J Bone Jointt Surg, 1954, 36B:304
40. Pritzker KP, ‘Aging and degeneration in the lumbar intervertebral disc’,
Orthop Clin North Am, 1977, 8:66
41. Marchand F, Ahmed AM, ‘Investigation of the laminate structure of lumbar disc anulus fibrosus’,
Spine, 1990, 15:402
42. Schollum ML, Robertson PA, Broom ND, ‘ISSLS prize winner. Microstructure and mechanical disruption of the lumbar disc annulus.
Part I. A microscopic investigation of the translamellar bridging network’,
Spine, 2008, 33:2702
43. Adams MA, Dolan P, ‘Time-dependent changes in the lumbar spine's resistance to bending’,
Clin Biomech, 1996, 11:194
44. Iatridis JC, Setton LA, Weidenbaum M et al., ‘Alterations in the mechanical behavior of the human lumbar nucleus pulposus with
degeneration and aging’,
J Orthop Res, 1997, 15:318
45. Johannessen W, Elliott DM, ‘Effects of degeneration on the biphasic material properties of human nucleus pulposus in confined
compression’,
Spine, 2005, 30:E724
46. Seroussi RE, Krag MH, Muller Dl et al., ‘Internal deformations of intact and denucleated human lumbar discs subjected to
compression, flexion, and extension loads’,
J Orthop Res, 1989, 7:122
47. Meakin JR, Redpath TW, Hukins DW, ‘The effect of partial removal of the nucleus pulposus from the intervertebral disc on the
response of the human annulus fibrosus to compression’,
Clin Biomech, 2001, 16:121
48. Iatridis JC, Laible JP, Krag MH, ‘Influence of fixed charge density magnitude and distribution on the intervertebral disc. Applications
of a poroelastic and chemical electric (PEACE) model’,
J Biomech Eng, 2003, 125:12
49. Shan Z, Li S, Liu J et al., ‘Correlation between biomechanical properties of the annulus fibrosus and magnetic resonance imaging
(MRI) findings’,
Eur Spine J, 2015, 24:1909
50. Skaggs DL, Weidenbaum M, Iatridis JC et al., ‘Regional variation in tensile properties and biochemical composition of the human
lumbar anulus fibrosus’,
Spine, 1994, 19:1310
51. Elliott DM, Setton LA, ‘Anisotropic and inhomogeneous tensile behavior of the human anulus fibrosus. Experimental measurement
and material model predictions’,
J Biomech Eng, 2001, 123:256
52. Holzapfel GA, Schulze-Bauer CA, Feigl G et al., ‚ Single lamellar mechanics of the human lumbar anulus fibrosus’,
Biomech Model Mechanobiol, 2005, 3:125
53. Stokes IA, Iatridis JC, ‘Mechanical conditions that accelerate intervertebral disc degeneration. Overload versus immobilization’,
Spine, 2004, 29:2724
54. Nerlich AG, Schleicher ED, Boos N, ‘1997 Volvo Award winner in basic science studies. Immunohistologic markers for age-related
changes of human lumbar intervertebral discs’,
Spine, 1997, 22:2781
55. Duance VC, Crean JK, Sims TJ et al., ‘Changes in collagen cross-linking in degenerative disc disease and scoliosis’,
Spine, 1998, 23:2545
56. Farfan HF, Cossette JW, Robertson GH et al., ‘The effects of torsion on the lumbar intervertebral joints. The role of torsion in the
production of disc degeneration’,
J Bone Joint Surg, 1970, 52A:468
57. Farfan HF, Gracovetsky S, ‘The nature of instability’,
Spine, 1984, 9:714
58. Adams MA, Bogduk N, Burton K, Dolan P, ‘The biomechanics of back pain. Third edition. Torsional damage’,
Churchill Livingstone, Elsevier, 2013:147
59. Burton AK, Tillotson KM, ‘Reference values for 'normal' regional lumbar sagittal mobility’,
Clin Biomech, 1988, 3:106
60. Sullivan MS, Dickinson CE, Troup JD, ‘The influence of age and gender on lumbar spine sagittal plane range of motion. A study of
1126 healthy subjects’,
Spine, 1994, 19:682
61. Bible JE, Simpson AK, Emerson JW et al., ‘Quantifying the effects of degeneration and other patient factors on lumbar segmental
range of motion using multivariate analysis’,
Spine, 2008, 33:1793
62. www.guy-declerck.com / Spinal Pathologies / Paravertebral Lumbar Spinal Muscles
63. Hilton RC, Ball J, Benn RT, ‘In-vitro mobility of the lumbar spine’,
Ann Rheum Dis, 1979, 38:378
64. Adams MA, Hutton WC, Stott JR, ‘The resistance to flexion of the lumbar intervertebral joint’,
Spine, 1980, 5:245
65. Lindström A, Zachrisson M, ‘Physical therapy on low back pain and sciatica’,
Scand J Rehabil Med, 1970, 2:37
66. Vernon-Roberts B, Pitie CJ, ‘Degenerative changes in the intervertebral discs of the lumbar spine and their sequelae’,
Rheumatol Rehab, 1977,16:13
* Guy Declerck, MD
. 1964, Grieks-Latijnse Humaniora
. 1978, Dokter in de Genees-,Heel-, en Verloskunde (KUL)
. 1983, Medische Specialist in de Orthopedie (KUL & Exeter, UK)
. 1988, Postgraduate Orthopedic Surgery (Plymouth & Liverpool, UK)
. 1989, Spinal Fellow in Adult Spinal Surgery (Perth, Australia)
. 1989, Research Fellow in Spinal Injuries & Rehabilitation (Perth, Australia)
. 1989, Neuromuscular Foundation of Western Australia Postgraduate Studentship
. 1992, Spinaal Orthopedisch Chirurg (Vlaanderen en buitenland)
. 1992, Medical Doctor National Belgian Judo Team
. 1993, European Spine Research Fellowship ‘Bionic Walking’ (Stoke-on-Trent, UK)
. 1994, Worldwide Encyclopaedia Invited Surgeon and SAFIR Spinal Travel Fellowship
. 2003, Rugchirurg-op-rust in Vlaanderen
. 2003-2006, Sabbatical
. 2007-2014, International Spinal Research, Spinal Scientific Advisory Consultant & Instructor
. 2007-now, Consultant Research & Development Innovative & Restorative Spinal Technologies
. 2007-now, Spinal Lecturing & Writing, Surgical Education (www.guy-declerck.com en www.hhp.be/nl/blog)
. 2012-now: President International Association Andullation Therapy (www.iaat.eu)












DISCUSSIE