Vieillir n’est pas sans conséquence. Les cellules discales doivent rapidement adapter leur stratégie
Avant-propos
Vieillir est un processus chimique inarrêtable et irréversible. Regardez des photos de vous, ou de votre famille, au fils des années. L’industrie des cosmétiques anti-âge a beau être omniprésente, elle ne peut rien changer aux milliers de réactions chimiques qui ont lieu à chaque instant dans nos 11 milliards de cellules. Les cellules perdent en effet progressivement leur capacité à produire de l’eau (en alliant deux atomes d’hydrogène et un atome d’oxygène). Le vieillissement se caractérise avant tout par une perte constante d’eau cellulaire. Bien entendu, cette perte d’eau influe également sur la production et la dégradation d’autres substances chimiques dans et autour des cellules. Dans une articulation cartilagineuse telle que celle du genou, de la hanche et du disque intervertébral, on a surtout étudié son effet sur les protéines de collagène et les protéoglycanes.
Toutes les cellules de cartilage ne vieillissent pas au même rythme
Dans les disques lombaires, le cartilage vieillit bien plus vite que dans les articulations des bras et des jambes. On ne comprend pas (encore) les mécanismes précis, mais les cellules de cartilage des bras et des jambes sont capables de maintenir un taux d’eau idéal bien plus longtemps. Cela permet à des articulations telles que celle de la hanche et du genou de résister bien plus longtemps aux lésions de surmenage, quotidiennes et microscopiques1a,1b (voir article « Arthrose des bras et jambes : ce que nous devrions tous savoir »). Au niveau des disques cervicaux également, ces phénomènes sont bien moins courants, et se déclarent habituellement bien plus tard que dans les disques lombaires. Étant donné que la nuque ne doit porter que le poids de la tête, mais doit être bien plus mobile que le bas du dos, le mécanisme hydraulique des disques cervicaux y est bien moins développé (voir article : « Fonction des disques du bas du dos »). C’est la raison pour laquelle les cellules des noyaux discaux des cervicales produisent lors de leur développement bien moins de protéoglycanes (capables de retenir l’eau) et bien plus de fibres de collagène de type 21c (Fig. 1). Les processus à l’œuvre entrainent malgré tout un vieillissement de toutes les structures cartilagineuses du corps, ce qui les rendent plus rigides et fragiles.

Fig. 1. Coupe médiane de six corps vertébraux (C2 jusqu’à C7) et leurs cinq disques intervertébraux (C2-C3 jusqu’à C6-C7) de la nuque d’un garçon de 9 ans (X89-1170 / Declerck — Kakulas, Neuropathology, Perth, Western Australia). Contrairement aux disques lombaires, les noyaux des disques cervicaux affichent un aspect gélatineux et semi-transparent bien moins prononcé. C’est ici clairement visible au niveau des disques C2-C3, C3-C4 et C4-C5. Les cellules des noyaux discaux de la nuque produisent bien moins de protéoglycanes, ce qui entraine une moins forte concentration en eau. Au niveau des disques C5-C6 et C6-C7, le noyau gélatineux et aqueux est bien visible. La plupart des mouvements au niveau de la nuque entrainent également des effets au niveau de ces disques inférieurs. C’est donc également la raison présumée pour laquelle la plupart des problèmes discogènes de la nuque trouvent leur origine à cet endroit.
Les disques du bas du dos vieillissent dès l’âge de 20 ans !
À 20 ans, les cellules notochordales ont disparu du noyau discal lombaire. Si elles pouvaient vivre plus longtemps, leur concentration en eau serait conservée plus longtemps et cela permettrait de retarder leur usure de quelques années (Fig. 2). Étant donné que l’anneau fibreux externe doit supporter les forces de compression du quotidien, ce vieillissement résulte en un bombement discal, phénomène normal mais qui s’aggrave progressivement2,3,4,5,6. Pour pouvoir malgré tout résister (voir article « Fonction des disques du bas du dos »), la nature renforce aussi bien le noyau et l’anneau externe que les plaques terminales. Si ce durcissement n’avait pas lieu, notre colonne vertébrale s’effondrerait sur elle-même. Malheureusement, il n’existe encore aucun moyen organique d’éviter le vieillissement et le déclin de ces noyaux discaux. En d’autres termes, il n’existe encore aucune thérapie permettant de stabiliser efficacement l’évolution de ce processus et éviter ainsi les douleurs lombaires.
Les noyaux discaux lombaires se fragilisent peu à peu
Les propriétés mécaniques des noyaux discaux de la zone lombaire dépendent de la quantité, de l’organisation et des propriétés spécifiques de leurs composants chimiques. Étant donné que les cellules notochordales ne survivent que jusqu’à l’adolescence, et que beaucoup moins de protéoglycanes sont produits par la suite, les noyaux sont fortement sollicités7,8,9,10,11,12,13,14. Les noyaux contiennent de moins en moins d’eau. Leur pression hydrostatique diminue2,3,7, ce qui réduit à son tour la production de protéoglycanes15. Aussi longtemps qu’il reste assez de fragments de protéoglycanes, la fonction hydraulique du noyau est préservée16. Pour la plupart d’entre nous, les noyaux discaux les plus fragiles se situent au niveau des vertèbres inférieures, c’est-à-dire au niveau des 4e et 5e lombaires et de la 1re sacrée (Fig. 3).
Les cellules du disque ne peuvent qu’adapter leur stratégie
Étant donné que les cellules notochordales meurent prématurément, et que la concentration en protéoglycanes et en eau diminue progressivement, les fibres de collagène élastique de type 2 des noyaux discaux se retrouvent compressées les unes contre les autres, se déforment et s’usent. Pour pouvoir préserver les fonctions discales, les cellules de cartilage restantes n’ont d’autre choix qu’adapter leur stratégie. Pour renforcer les noyaux discaux, elles produisent des fibres de collagène (de type 1) plus épaisses, résistantes et moins élastique17,18,19,20. Cela causera un durcissement du noyau, qui ressemblera de plus en plus à du tissu cicatriciel rigide, floutant progressivement la délimitation entre le noyau et l’anneau fibreux qui l’encercle22,23. Dans les disques encore jeunes et sains, cette limite est facilement visible. À mesure que le noyau vieillit cependant, il ressemble de plus en plus à l’anneau externe24 (Fig. 2 et Fig. 3).
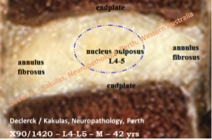
Fig. 2. Malgré un travail physique particulièrement dur pour le dos, cet homme de 42 ans n’a jamais fait état de douleurs dorsales. Le disque L4-L5 n’affiche qu’un petit nombre de signes de vieillissement, mais le noyau est devenu bien blanc. Ce dernier a perdu sa concentration en eau et son apparence transparente gélatineuse pour ressembler de plus en plus à du tissu cicatriciel. La délimitation entre le noyau et l’anneau externe n’est plus aussi clairement visible. Noyau et anneau fibreux se ressemblent déjà beaucoup. La hauteur du disque est conservée, ce qui indique qu’il n’y a pas encore eu de dégradation (voir article suivant). Il n’y a encore aucune déchirure ou fissure visible (A90-1420 / Declerck — Kakulas, Neuropathology, Perth, Western Australia).
Les noyaux discaux ressemblent peu à peu à du tissu cicatriciel
À mesure qu’ils vieillissent, les noyaux discaux ressemblent de plus en plus au tissu que l’on retrouve lors de la formation d’une cicatrice25,26 (Fig. 2 et Fig. 3). Les noyaux s’assèchent, perdent leur élasticité et s’endurcissent27,28,29,30. Vu que le tissu cicatriciel ne contient normalement pas de nerfs, cette phase du vieillissement du noyau discal n’est pas douloureuse.
Ce fait, important et en constante évolution, constitue la raison pour laquelle les gens continuent de rechercher des traitements biologiques innovants et efficaces des lombalgies. On a déjà réussi, sur des animaux en laboratoire, à transformer certaines cellules souches en des cellules cicatricielles (= fibroblastes), à les injecter dans les noyaux discaux et à transformer complètement le disque en tissu cicatriciel. Avec des résultats similaires chez l’Homme31, il serait possible de déclencher plus tôt la transformation de notre disque, avant que les douleurs ne se déclarent et que la hauteur du disque ne diminue (Fig. 3). La nature veille à ce que tous nos disques se transforment spontanément en tissu cicatriciel. Le problème : cela prend beaucoup trop de temps ! Dans les articles à venir, nous expliquerons l’importance d’imiter ce processus discogène.
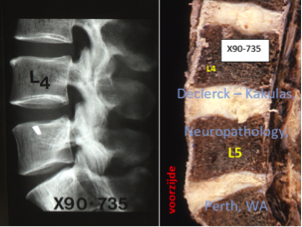
Illustration d’un début de dégénérescence discale au niveau du disque L5-S1 chez un homme de 38 ans qui fait état de douleurs lombaires. Lors du processus de vieillissement, la structure du disque lombaire s’altère drastiquement. La concentration en eau du noyau diminue, et la production de fibres de collagène de type 1, plus coriaces, augmente. L’apparence transparente et gélatineuse du noyau disparait. Les disques ressemblent peu à peu à du tissu cicatriciel blanc. On peut encore voir, au niveau des disques L3-L4 et L4-L5, que les noyaux sont encore plus ou moins situés au centre, bien que la délimitation entre noyau et anneau externe a presque disparu. La hauteur de ces disques n’a pas encore diminué, ce qui indique que la dégénérescence n’est pas encore trop avancée. Au niveau des disques L5-S1, la situation est bien différente. La position du noyau n’est plus visible. La couleur du disque est brun-jaune, ce qui indique un vieillissement. La hauteur de disque a également fortement diminué, ce qui indique que la dégénérescence est déjà bien avancée. On perçoit des fissures. On n’a cependant pas vérifié si l’anneau fibreux présentait des fissures. Sa structure à l’avant est cependant fort différente de celle à l’arrière (X90-735, M, 38 ans / Declerck — Kakulas, Neuropathology, Perth, Western Australia).
La métamorphose des noyaux influence les deux autres structures du disque
La métamorphose prématurée du noyau discal gélatineux, initialement semi-liquide et transparente, en une structure cicatricielle solide32,33 a des conséquences drastiques sur les deux autres parties du disque. Étant donné que le processus de vieillissement des noyaux n’est pas réversible, les plaques terminales et l’anneau fibreux font face à une pression croissante, ce qui peut causer des ruptures et déchirures34.
D’abord, un renforcement des plaques terminales
En temps normal, la nature va d’abord renforcer les plaques terminales8. Une fois que plus de fibres de collagène coriace (type 1) ont été produites, les plaques terminales vont commencer à se calcifier et s’ossifier, ce qui leur fait perdre leur flexibilité. Malgré tout, les plaques terminales restent le maillon le plus faible de la chaîne du disque, leurs fissures et fractures constituant la raison principale des douleurs dans le bas du dos (voir article « Douleurs lombaires chez les jeunes : les plaques terminales, première cause des douleurs »).
L’anneau fibreux externe est renforcé
Les processus de vieillissement sont moins susceptibles d’affecter les anneaux fibreux externes35,36. Dès le moment où ils sont obligés de participer à l’effort afin de répartir les forces de compression, ils doivent, c’est vrai, se renforcer et s’endurcir37. Pour protéger les noyaux aussi longtemps que possible, la nature a veillé à ce que ces structures externes, déjà très solides, se renforcent encore pour éviter les fissures douloureuses. C’est pourquoi il y a plus de fibres de collagène coriace produites à l’intérieur et dans la couche intermédiaire22,38,39,40,41. S’il y a malgré tout des déchirures, elles peuvent alors s’étendre à l’ensemble de l’anneau42, causant par la même occasion des douleurs lombaires.
Pour finir, c’est l’ensemble du disque qui subit ce processus de vieillissement
Les noyaux des disques vieillissants et asséchés perdent leur incompressibilité typique43,44,45, ce qui comporte un grand risque. Étant donné qu’ils doivent amortir les charges quotidiennes, ils doivent progressivement compter sur les anneaux fibreux externes46,47. Les disques commençant alors à ressembler de plus en plus à du tissu cicatriciel et à perdre leur élasticité, une tension croissante finira par provoquer de gros problèmes au niveau des anneaux fibreux.
Le stress mécanique endommage aussi le noyau
Face au stress mécanique quotidien, la tension de ces fibres de collagène coriace augmente également7,43,48. Elles fatiguent et seront moins capables de résister49. Initialement, ce n’était pas un problème, mais les anneaux fibreux externes qui se trouvent sous grande pression finissent par former des bombements visibles (mais indolores) par IRM. Ces phénomènes apparaissent surtout à l’arrière des deux disques inférieurs, car ces zones sont moins raides à qu’à l’avant (voir le disque L5-S1 sur Fig. 3)36,49,50,51,52. Face à la pression constamment changeante, les fibres de collagène situées à l’arrière se retrouvent plus étirées et plus usées. Pour terminer, l’anneau fibreux finira par céder et se déchirer53. Lorsque ces problèmes s’additionnent, cela peut vite mener à une cascade de lésions dégénératives18,19,20,53,54,55 qui ne peuvent généralement plus être guéries53. C’est probablement la raison première pour laquelle des vagues de douleurs peuvent survenir régulièrement au niveau lombaire (plus à ce sujet dans les articles à venir). Cependant, le repos fait rouiller, et le disque continuera à s’éroder, quoi que l’on fasse. Nous n’avons donc, en tant que bipède face à ces pics de douleur, pas d’autres choix que de solliciter et mobiliser au plus vite notre zone lombaire.
Pour la plupart d’entre nous (+/— 80 %), ce processus de vieillissement est à l’origine du dérèglement de la fonction discale66 et l’apparition de douleurs lombaires. Dans environ 20 % des cas, des problèmes plus graves expliquent les douleurs lombaires (voir article « La cause de la lombalgie ne peut être déterminée avec certitude que dans 15 % à 20 % des cas »).
Ce sont surtout les mouvements de rotation qui provoquent des déchirures du disque
En laboratoire, on a étudié ce qu’il se passait dans les disques intacts de la zone lombaire lorsque des mouvements de rotation, toujours plus nombreux et de plus grande amplitude, ont lieu. Ce sont principalement les fibres de collagène coriace de l’anneau fibreux, sur la face postérieure, qui sont impactées. Elles sont de plus en plus tendues, étirées jusqu’à ce qu’elle rompe (Fig. 4)56,57,58. Ces déchirures du disque « externe » ne provoquent pas de hernie, mais sont cependant bel et bien la cause des douleurs dans le bas du dos. On peut donc supposer que ces déchirures externes se propageront jusqu’à l’intérieur, à côté du noyau (« out-to-in tears »), ce qui pourrait provoquer l’apparition de hernie. Il n’y a cependant à ce jour aucune preuve scientifique qui aille dans ce sens58.
Les fibres de collagène dans la partie interne de l’anneau fibreux, qui se trouvent donc le plus près du noyau, ne cèdent pas. La nature veille à ce que, face aux processus de vieillissement, la partie interne soit la plus renforcée (voir plus haut) et perde donc de son élasticité42. C’est donc une défense supplémentaire offerte par la nature. Le noyau du disque lombaire doit, lors des potentielles dégénérescences ultérieures des disques, être maintenu le plus longtemps possible à sa place afin de ne pas former une hernie. Néanmoins, dès le moment où la dégénérescence est bien avancée, des déchirures apparaissent dans les zones internes. Le noyau du disque peut alors s’y introduire sous la pression (« in-to-out tears ») et provoquer l’apparition d’une hernie dégénérative. Dans ces conditions, des douleurs bien plus intenses que celles du bas du dos se déclarent alors dans les jambes. Nous aborderons dans un article à venir la problématique de la hernie discale.
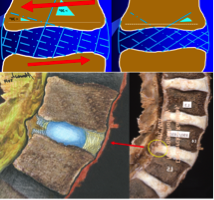
Fig. 4. L’anneau fibreux peut être comparé, en termes de robustesse, à une clôture de jardin composé d’une vingtaine de palissades placées l’une contre l’autre et dont le grillage s’oriente dans des directions opposées (voir article « Douleurs lombaires chez les jeunes patients. Le rôle du noyau et de l’anneau externe jusqu’à 15 ans »). Lorsque nous pivotons autour de notre axe corporel, toutes les fibres sont étirées dans la même direction. Toutes les fibres des palissades qui s’orientent horizontalement se font alors étirer et sont susceptibles de se déchirer sous la tension. Dans d’autres palissades, les fibres s’orientent verticalement, ce qui fait que la tension qui s’y crée est moins forte. La flèche rouge dans la partie supérieure du dessin indique la direction de la torsion en conditions de laboratoire. Les fibres subissant la plus grande tension seront les premières à se déchirer (illustration du dessus). Cela arrive donc principalement dans les fibres les plus éloignées du noyau discal (dessin du dessous). Lors des mouvements de rotation, les déchirures apparaissent donc principalement sur la couche externe du disque (Declerck / Kakulas, X89-1450, L4-L5, M, 22 yrs. Illustration par Alonso Ríos, sculpteur, dessinateur et peintre colombien — www.alonsoriosecultor.com).
La rigidité de la colonne ne signifie pas toujours l’apparition de douleurs
Nous savons tous que la mobilité de la colonne vertébrale va, pour la plupart d’entre nous, diminuer à mesure que l’on vieillit. Notre capacité à nous pencher et nous redresser diminue en moyenne de 20 % entre 20 et 55 ans59,60,61. Les coupes sagittales et les analyses post-mortem des colonnes vertébrales ont démontré que les muscles n’y étaient pour rien62 (voir article « Que faut-il savoir des muscles abdominaux et dorsaux ? »). Les limitations de mouvement sont principalement dues à un vieillissement des structures du disque63,64. Une limitation croissante des mouvements n’est pas forcément une mauvaise chose. À mesure que le bas du dos se renforce, les douleurs lombaires chroniques diminuent65.
Le prochain article abordera les altérations des disques lombaires visibles par radio causées par la vieillesse.
Références
1a. Ferguson RJ, Palmer AJR, Taylor A et al., ‘Hip and knee replacement 1. Hip replacement’, Lancet, 2018, 392:1662
1b. Price AJ, Alvand A, Troelsen A et al., ‘Hip and knee replacement 2. Knee replacement’, Lancet, 2018, 392:1672
1c. Scott JE, Bosworth TR, Cribb AM, Taylor JR, ‘The chemical morphology of age-related changes in human intervertebral disc glycosaminoglycans from cervical, thoracic and lumbar nucleus pulposus and annulus fibrosus’, J Anat, 1994, 184:73
2. Adams MA, McNally DS, Dolan P, ‘'Stress' distributions inside intervertebral discs. The effects of age and degeneration’, J Bone Joint Surg, 1996, 78B:965
3. Sato K, Kikuchi S, Yonezawa T, ‘In vivo intradiscal pressure measurement in healthy individuals and in patients with ongoing back problems’, Spine, 1999, 24:2468
4. Iatridis JC, Setton LA, Foster RJ et al., ‘Degeneration affects the anisotropic and nonlinear behaviors of human anulus fibrosus in compression’, J Biomech, 1998, 31:535
5. Iatridis JC, Kumar S, Foster RJ et al., ‘Shear mechanical properties of human lumbar annulus fibrosus’, J Orthop Res, 1999, 17:732
6. O'Connell GD 1 , Guerin HL, Elliott DM, ‘Theoretical and uniaxial experimental evaluation of human annulus fibrosus degeneration’, J Biomech Eng, 2009, 131:111007
7. Buckwalter JA, ‘Aging and degeneration of the human intervertebral disc’, Spine, 1995, 20:1307
8. Boos N, Weissbach S, Rohrbach H et al., ‘Classification of age-related changes in lumbar intervertebral discs. 2002 Volvo Award in basic science’, Spine, 2002, 27:2631
9. Adams MA, Hutton WC, ‘The effect of posture on the fluid content of lumbar intervertebral discs’, Spine, 1983, 8:665
10. Antoniou J, Steffen T, Nelson F et al., ‘The human lumbar intervertebral disc. Evidence for changes in the biosynthesis and denaturation of the extracellular matrix with growth, maturation, ageing, and degeneration’, J Clin Invest, 1996, 98:996
11. Urban JP, Roberts S, ‘Degeneration of the intervertebral disc’, Arthritis Res Ther, 2003, 5:120
12. Gower WE, Pedrini V, ‘Age-related variations in proteinpolysaccharides from human nucleus pulposus, annulus fibrosus, and costal cartilage’, J Bone Joint Surg, 1969, 51A:1154
13. Kraemer J, Kolditz D, Gowin R, ‘Water and electrolyte content of human intervertebral discs under variable load’, Spine, 1985, 10:69
14. Urban JP, McMullin JF, ‘Swelling pressure of the lumbar intervertebral discs. Influence of age, spinal level, composition, and degeneration’, Spine, 1988, 13:179
15. Ishihara H, McNally DS, Urban JP et al., ‘Effects of hydrostatic pressure on matrix synthesis in different regions of the intervertebral disk’, J Appl Physiol, 1996, 80:839
16. Roughley PJ, ‘Biology of intervertebral disc aging and degeneration. Involvement of the extracellular matrix’, Spine, 2004, 29:2691
17. Singh K, Masuda K, Thonar EJMA et al., ‘Age-related changes in the extracellular matrix of nucleus pulposus and anulus fibrosus of human intervertebral disc’, Spine, 2009, 34:10
18. Bischop PB, Pearce RH, ‘The proteoglycans of the cartilaginous end-plate of the human intervertebral disc change after maturity’, J Orthop Res, 1993, 11:324
19. Pokharna HK, Phillips FM, ‘Collagen crosslinks in human lumbar intervertebral disc aging’, Spine, 1998, 23:1645
20. DeGroot J, Verzijl N, Wenting-van Wijk MJ et al., ‘Accumulation of advanced glycation end products as a molecular mechanism for aging as a risk factor in osteoarthritis’, Arthritis Rheum, 2004, 50:1207
21. Wagner DR, Reiser KM, Lotz JC, ‘Glycation increases human annulus fibrosus stiffness in both experimental measurements and theoretical predictions’, J Biomech, 2006, 39:1021
22. Coventry MB, Ghormley RK, Kernohan JW, ‘The intervertebral disc. Its microscopic anatomy and pathology. Part I. Anatomy, development and physiology’, J Bone Joint Surg, 1945, 27A:105
23. Vernon-Roberts B, Fazzalari NL, Manthey BA, ‘Pathogenesis of tears of the anulus investigated by multiple-level transaxial analysis of T12-L1 disc’, Spine, 1997, 22:2641
24. Sivan SS, Wachtel E, Tsitron E et al., ‘Collagen turnover in normal and degenerate human intervertebral discs as determined by the racemization of aspartic acid’, J Biol Chem, 2008, 283:8796
25. Thompson JP, Pearce RH, Schechter MT et al., ‘Preliminary evaluation of a scheme for grading the gross morphology of the human intervertebral disc’, Spine, 1990, 15:411
26. Vernon-Roberts B, ‘Age related and degenerative pathology of the intervertebral discs and apophyseal joints’, In Jayson MIV (ed), ‘The lumbar spine and back pain’, Churchill Livingstone, London, 1992, Vol 4:17
27. Adams MA, Dolan P, Hutton WC, ‘The stages of disc degeneration as revealed by discograms’, J Bone Joint Surg, 1986, 68B:36
28. Umehara S, Tadano S, Abumi K et al., ‘Effects of degeneration on the elastic modulus distribution in the lumbar intervertebral disc’, Spine, 1996, 21:811 and further discussion:820
29. Wagner DR, Reiser KM, Lotz JC, ‘Glycation increases human annulus fibrosus stiffness in both experimental measurements and theoretical predictions’, J Biomech, 2006, 39:1021
30. Haefeli M, Klaberer F, Saegesser D et al., ‘The course of macroscopic degeneration in the human lumbar intervertebral disc’, Spine, 2006, 31:1522
31. www.guy-declerck.com / Degenerative discogenic syndrome / Therapeutic considerations
32. McDevitt CA, ‘Proteoglycans of intervertebral disc’, In: Ghosh P (ed), ‘The biology of the intervertebral disc’, Florida, Boca Raton, CRC Press, 1988:151
33. Gruber HE, Hanley EN Jr, ’Analysis of aging and degeneration of the human intervertebral disc. Comparison of surgical specimens with normal controls’, Spine, 1998, 23:751
34. Cheung KM, Samartzis D, Karppinen J et al., ‘Intervertebral disc degeneration. New insights based on "skipped" level disc pathology’, Arthritis Rheum, 2010, 62:2392
35. Acaroglu ER, Iatridis JC, Setton LA et al., ‘Degeneration and aging affect the tensile behavior of human lumbar anulus fibrosus’ Spine, 1995, 20:2690
36. Ebara S, Iatridis JC, Setton LA, et al., ‘Tensile properties of nondegenerate human lumbar anulus fibrosus’, Spine, 1996, 21:452
37. Bank RA, Bayliss MT, Lafeber FP et al., ‘Ageing and zonal variation in post-translational modification of collagen in normal human articular cartilage. The age-related increase in non-enzymatic glycation affects biomechanical properties of cartilage’, Biochem J, 1998, 330:345
38. Hirsch C, Schajowicz F, ‘Studies on structural changes in the lumbar annulus fibrosus’, Acta Orthop Scand, 1953, 22:184
39. Harris RI, MacNab I, ‘Structural changes in the lumbar intervertebral discs. Their relationship to low back pain and sciatica’, J Bone Jointt Surg, 1954, 36B:304
40. Pritzker KP, ‘Aging and degeneration in the lumbar intervertebral disc’, Orthop Clin North Am, 1977, 8:66
41. Marchand F, Ahmed AM, ‘Investigation of the laminate structure of lumbar disc anulus fibrosus’, Spine, 1990, 15:402
42. Schollum ML, Robertson PA, Broom ND, ‘ISSLS prize winner. Microstructure and mechanical disruption of the lumbar disc annulus. Part I. A microscopic investigation of the translamellar bridging network’, Spine, 2008, 33:2702
43. Adams MA, Dolan P, ‘Time-dependent changes in the lumbar spine's resistance to bending’, Clin Biomech, 1996, 11:194
44. Iatridis JC, Setton LA, Weidenbaum M et al., ‘Alterations in the mechanical behavior of the human lumbar nucleus pulposus with degeneration and aging’, J Orthop Res, 1997, 15:318
45. Johannessen W, Elliott DM, ‘Effects of degeneration on the biphasic material properties of human nucleus pulposus in confined compression’, Spine, 2005, 30:E724
46. Seroussi RE, Krag MH, Muller Dl et al., ‘Internal deformations of intact and denucleated human lumbar discs subjected to compression, flexion, and extension loads’, J Orthop Res, 1989, 7:122
47. Meakin JR, Redpath TW, Hukins DW, ‘The effect of partial removal of the nucleus pulposus from the intervertebral disc on the response of the human annulus fibrosus to compression’, Clin Biomech, 2001, 16:121
48. Iatridis JC, Laible JP, Krag MH, ‘Influence of fixed charge density magnitude and distribution on the intervertebral disc. Applications of a poroelastic and chemical electric (PEACE) model’, J Biomech Eng, 2003, 125:12
49. Shan Z, Li S, Liu J et al., ‘Correlation between biomechanical properties of the annulus fibrosus and magnetic resonance imaging (MRI) findings’, Eur Spine J, 2015, 24:1909
50. Skaggs DL, Weidenbaum M, Iatridis JC et al., ‘Regional variation in tensile properties and biochemical composition of the human lumbar anulus fibrosus’, Spine, 1994, 19:1310
51. Elliott DM, Setton LA, ‘Anisotropic and inhomogeneous tensile behavior of the human anulus fibrosus. Experimental measurement and material model predictions’, J Biomech Eng, 2001, 123:256
52. Holzapfel GA, Schulze-Bauer CA, Feigl G et al., ‚ Single lamellar mechanics of the human lumbar anulus fibrosus’, Biomech Model Mechanobiol, 2005, 3:125
53. Stokes IA, Iatridis JC, ‘Mechanical conditions that accelerate intervertebral disc degeneration. Overload versus immobilization’, Spine, 2004, 29:2724
54. Nerlich AG, Schleicher ED, Boos N, ‘1997 Volvo Award winner in basic science studies. Immunohistologic markers for age-related changes of human lumbar intervertebral discs’, Spine, 1997, 22:2781
55. Duance VC, Crean JK, Sims TJ et al., ‘Changes in collagen cross-linking in degenerative disc disease and scoliosis’, Spine, 1998, 23:2545
56. Farfan HF, Cossette JW, Robertson GH et al., ‘The effects of torsion on the lumbar intervertebral joints. The role of torsion in the production of disc degeneration’, J Bone Joint Surg, 1970, 52A:468
57. Farfan HF, Gracovetsky S, ‘The nature of instability’, Spine, 1984, 9:714
58. Adams MA, Bogduk N, Burton K, Dolan P, ‘The biomechanics of back pain. Third edition. Torsional damage’, Churchill Livingstone, Elsevier, 2013:147
59. Burton AK, Tillotson KM, ‘Reference values for 'normal' regional lumbar sagittal mobility’, Clin Biomech, 1988, 3:106
60. Sullivan MS, Dickinson CE, Troup JD, ‘The influence of age and gender on lumbar spine sagittal plane range of motion. A study of 1126 healthy subjects’, Spine, 1994, 19:682
61. Bible JE, Simpson AK, Emerson JW et al., ‘Quantifying the effects of degeneration and other patient factors on lumbar segmental range of motion using multivariate analysis’, Spine, 2008, 33:1793
62. www.guy-declerck.com / Spinal Pathologies / Paravertebral Lumbar Spinal Muscles
63. Hilton RC, Ball J, Benn RT, ‘In-vitro mobility of the lumbar spine’, Ann Rheum Dis, 1979, 38:378
64. Adams MA, Hutton WC, Stott JR, ‘The resistance to flexion of the lumbar intervertebral joint’, Spine, 1980, 5:245
65. Lindström A, Zachrisson M, ‘Physical therapy on low back pain and sciatica’, Scand J Rehabil Med, 1970, 2:37
66. Vernon-Roberts B, Pitie CJ, ‘Degenerative changes in the intervertebral discs of the lumbar spine and their sequelae’, Rheumatol Rehab, 1977,16:13
* Guy Declerck, MD
. 1964, Grieks-Latijnse Humaniora
. 1978, Dokter in de Genees-,Heel-, en Verloskunde (KUL)
. 1983, Medische Specialist in de Orthopedie (KUL & Exeter, UK)
. 1988, Postgraduate Orthopedic Surgery (Plymouth & Liverpool, UK)
. 1989, Spinal Fellow in Adult Spinal Surgery (Perth, Australia)
. 1989, Research Fellow in Spinal Injuries & Rehabilitation (Perth, Australia)
. 1989, Neuromuscular Foundation of Western Australia Postgraduate Studentship
. 1992, Spinaal Orthopedisch Chirurg (Vlaanderen en buitenland)
. 1992, Medical Doctor National Belgian Judo Team
. 1993, European Spine Research Fellowship ‘Bionic Walking’ (Stoke-on-Trent, UK)
. 1994, Worldwide Encyclopaedia Invited Surgeon and SAFIR Spinal Travel Fellowship
. 2003, Rugchirurg-op-rust in Vlaanderen
. 2003-2006, Sabbatical
. 2007-2014, International Spinal Research, Spinal Scientific Advisory Consultant & Instructor
. 2007-now, Consultant Research & Development Innovative & Restorative Spinal Technologies
. 2007-now, Spinal Lecturing & Writing, Surgical Education (www.guy-declerck.com en www.hhp.be/nl/blog)
. 2012-now: President International Association Andullation Therapy (www.iaat.eu)











Réactions