Nous payons le prix fort pour le vieillissement de nos disques lombaires
Avant-propos
Le disque lombaire sain est un organe complexe. La majorité des connaissances scientifiques à ce sujet repose principalement sur la recherche directe, menée sur les souris, rats, lapins, chiens, moutons, chèvres, singes et porcs. Les disques des animaux sont visiblement différents des disques de l’être humain. Grâce à l’évolution naturelle, l’espèce humaine a fini par se redresser sur ses deux jambes. L’évolution exige en réalité du temps. Le plus vieil animal sans pattes connu vivait sur Terre il y a environ 572 millions d’années1a. Le « pouvoir de l’évolution » est néanmoins puissant. Pour avoir présenté les éléments chimiques qui le prouvent, Frances Arnold a reçu en 2018 le prix Nobel de chimie1b.
Il est dommage que les trois parties du disque lombaire ne puissent toujours pas s’adapter aux forces variables auxquelles elles sont soumises jour et nuit. L’homme adulte n’est donc pas capable de maintenir intacte la structure du noyau discal, de l’anneau fibreux et des plaques terminales. La composition du disque change aussi de plus en plus vite à mesure que l’on vieillit et qu’il s’use1c. Mais vieillissement et usure ne signifient pas la même chose2.
Chez les animaux, on peut accélérer le vieillissement du disque
Aucune ingéniosité technique n’est requise pour accélérer le vieillissement des disques chez les animaux. Les données concernant les cellules du disque animal et leur environnement semblent correspondre à celles disponibles sur le disque de l’Homme, obtenues par discectomie ou autopsie3,4,5,6. Néanmoins, on ne peut démontrer avec certitude que les découvertes faites chez les animaux sont également d’application chez l’Homme.
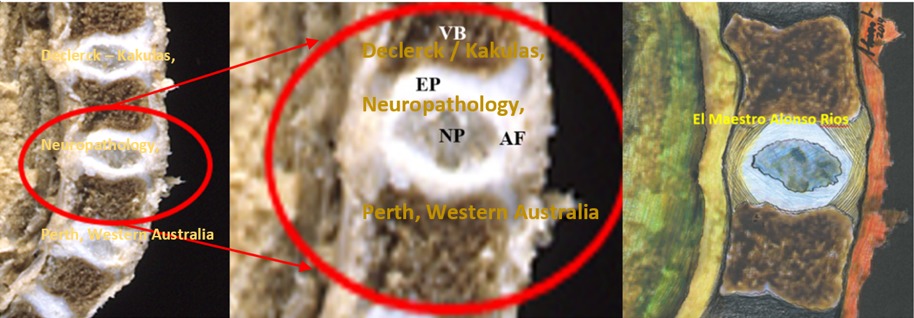 Dans le jeune disque intact L4-L5, âgé d’un mois (X83-478), on peut clairement voir une séparation entre le noyau, l’anneau fibreux externe et les plaques terminales au-dessus et en dessous. Étant donné que ces disques n’ont jamais été confrontés aux charges mécaniques variables qui se créent lorsque l’on s’assied ou qu’on se lève, et donc ont beaucoup moins souffert du rythme jour-nuit du disque (voir article « Le rythme jour-nuit du disque intervertébral »), les noyaux gardent intacte leur structure gélatineuse, gorgée d’eau. La grande pression hydrostatique présente dans les noyaux est probablement la raison pour laquelle presque aucun vaisseau sanguin ou nerf ne peut se développer dans l’anneau fibreux et les plaques terminales. La pression de l’eau à l’intérieur des noyaux étant beaucoup plus grande que la pression des vaisseaux sanguins qui l’encercle, ils finiraient écrasés à chaque fois que l’on s’assied ou se lève. À cet âge, l’anneau externe et les plaques terminales ont encore leur forme originale (Declerck / Kakulas, Neuropathology, Perth, Western Australia et illustration par Alonso Ríos, sculpteur colombien, dessinateur et peintre — www.alonsoriosescultor.com).
Dans le jeune disque intact L4-L5, âgé d’un mois (X83-478), on peut clairement voir une séparation entre le noyau, l’anneau fibreux externe et les plaques terminales au-dessus et en dessous. Étant donné que ces disques n’ont jamais été confrontés aux charges mécaniques variables qui se créent lorsque l’on s’assied ou qu’on se lève, et donc ont beaucoup moins souffert du rythme jour-nuit du disque (voir article « Le rythme jour-nuit du disque intervertébral »), les noyaux gardent intacte leur structure gélatineuse, gorgée d’eau. La grande pression hydrostatique présente dans les noyaux est probablement la raison pour laquelle presque aucun vaisseau sanguin ou nerf ne peut se développer dans l’anneau fibreux et les plaques terminales. La pression de l’eau à l’intérieur des noyaux étant beaucoup plus grande que la pression des vaisseaux sanguins qui l’encercle, ils finiraient écrasés à chaque fois que l’on s’assied ou se lève. À cet âge, l’anneau externe et les plaques terminales ont encore leur forme originale (Declerck / Kakulas, Neuropathology, Perth, Western Australia et illustration par Alonso Ríos, sculpteur colombien, dessinateur et peintre — www.alonsoriosescultor.com).
Les disques lombaires de l’Homme commencent très tôt à vieillir
Chez tout le monde, des facteurs génétiques rentrent en ligne de compte dans le vieillissement des 23 disques de la colonne vertébrale (voir article « La cause principale des douleurs lombaires est un mauvais héritage génétique »). Néanmoins, les phénomènes de vieillesse et d’usure — puis de dégénérescence — se déclarent bien plus tôt et plus sérieusement dans le bas du dos7. Les ravages du temps sont aussi les plus visibles sur les disques lombaires, principalement les disques en L3-L4, en L4-L5 et en L5-S18,9a. C’est également dans les noyaux de ces disques que nous pourrons observer par IRM les premières altérations. Elles sont dues aux forces mécaniques toujours plus grandes qui s’y exercent continuellement9b. Les disques les plus bas ne sont d’ailleurs pas du tout conçus pour pouvoir résister sur le long terme aux forces qui se créent lorsque nous nous asseyons, nous levons, marchons, travaillons, faisons du sport, etc.
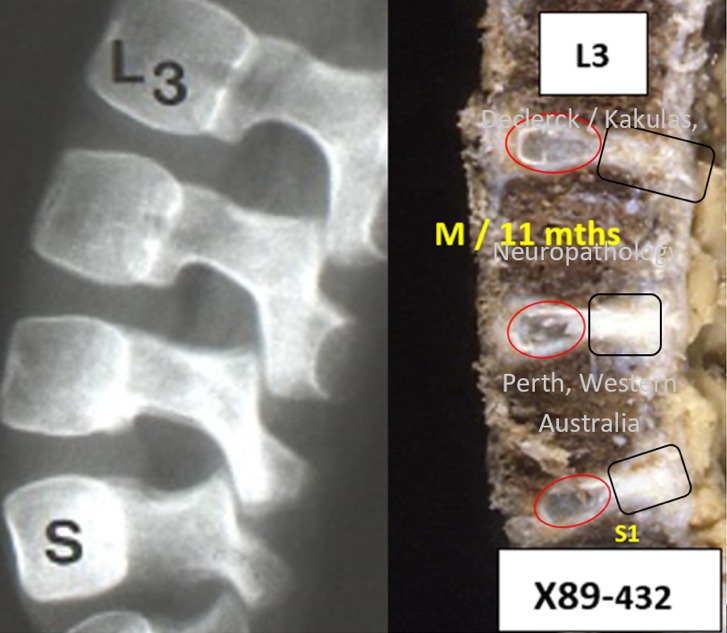
Ce nourrisson de presque un an (X89-432) a gagné, lentement mais sûrement, la bataille contre la gravité. Depuis à peu près deux mois, il arrive à s’asseoir seul, se redresser et se maintenir debout en s’appuyant. Étant donné que sa colonne ne forme pas encore tout à fait un S, la courbe du bas de son dos n’est pas suffisamment marquée (= lordose lombaire) et ses muscles dorsaux n’étant pas encore assez développés (voir article « La colonne vertébrale »), il n’arrive pas à se maintenir longtemps debout et tombe régulièrement sur son derrière. Les noyaux gorgés d’eau, encore relativement petits, au niveau des disques L3-L4, L4-L5 et L5-S1 (cercles rouges) ne sont plus placés de façon centrale, mais légèrement décalés vers l’arrière. Ce haut taux en eau des noyaux leur permet d’amortir sans problème les forces de compressions à l’œuvre lorsque l’on s’assied ou se lève. Les propriétés hydrostatiques sont d’ailleurs encore intactes. L’arrière de l’anneau fibreux est encore assez épais (cadres noirs). Les corps vertébraux adjacents, encore peu développés, sont séparés des disques par des plaques terminales cartilagineuses, qui s’épaississent avec l’âge mais restent flexibles. Cette caractéristique peut d’ailleurs être démontrée et mesurée en laboratoire (voir article « Douleurs lombaires chez les jeunes : les plaques terminales, première cause des douleurs
À 15 ans, toutes les défenses naturelles disparaissent
À l’adolescence, toutes les cellules notochordales des noyaux discaux ont disparu5. Chez la plupart des quadrupèdes, ces cellules sont présentes tout au long de leur vie et les protègent du vieillissement et de la dégénérescence prématurés des disques. Ces cellules sont responsables de la production d’un grand nombre de protéoglycanes, capables d’absorber et maintenir l’eau environnante (voir article « Douleurs lombaires chez les jeunes : les plaques terminales, première cause des douleurs »). Cela leur garantit de maintenir leur fonction hydraulique (voir article « Fonctions des disques du bas du dos »). Si la quantité de protéoglycanes diminue, cela signifie aussi une perte d’eau. Étant donné que la déshydratation est la caractéristique principale du processus de vieillissement, cette perte mène à une dégénérescence prématurée des disques.
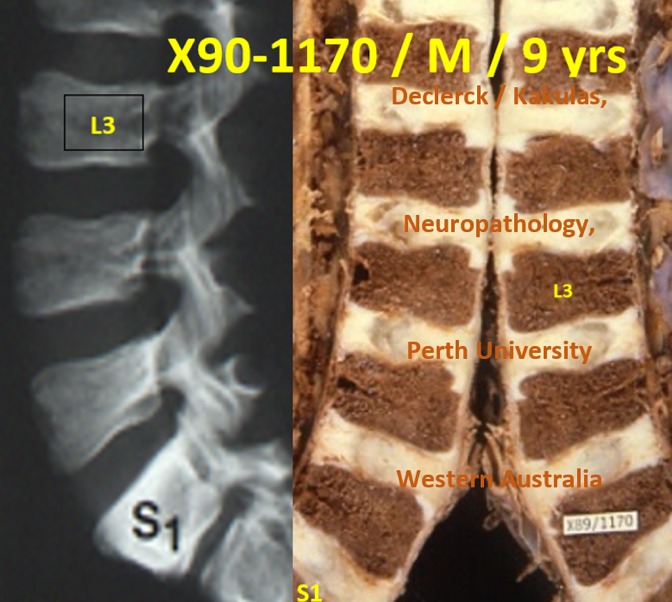
Dès l’âge de 9 ans, la colonne réagit parfaitement aux contraintes mécaniques de la pesanteur et des mouvements du quotidien. Les petits corps vertébraux n’ont pas encore complètement atteint leur forme définitive. Ils sont pourtant assez résistants que pour ne pas casser. C’est seulement à la fin de l’adolescence que le corps vertébral est achevé (voir article « Le corps vertébral »). À cet âge, les disques ont aussi leur forme définitive. Les noyaux discaux, encore intacts et gorgés d’eau, constituent les parties internes des disques — mais légèrement décalées vers l’arrière (cercles rouges). Leur diamètre et volume équivaut à 40 % du volume total du disque. Tant que les noyaux contiennent suffisamment d’eau (l’eau n’est pas compressible), ils restent capables de faire face aux différentes forces hydrostatiques sans former de bombements discaux. Les noyaux, en forme de ballon de rugby, sont maintenus en place par des anneaux fibreux résistants et plus larges. À l’arrière, l’anneau est moins épais qu’à l’avant. C’est au niveau de cette zone que des bombements indolores commencent à se former. Au-dessus et en dessous, des noyaux des corps vertébraux se trouvent les plaques terminales cartilagineuses. Sur ces images, elles sont encore intactes (voir article « Douleurs lombaires chez les jeunes : les plaques terminales, première cause des douleurs »).
Après 15 ans, le nombre de cellules du disque diminue irrémédiablement
Dans la zone lombaire, les cellules discales ne représentent que 1 % du poids total du disque5. Le nombre total de cellules dans un tissu est aux alentours de 14 000 000/cm³. L’anneau fibreux peut contenir, jusqu’à un âge avancé, jusqu’à 9 000 000 cellules par cm³. C’est pourquoi il est capable de résorber de petites déchirures (plus à ce sujet dans les articles à venir). À l’inverse, le noyau n’en contient qu’un maximum de 4 000 000/cm³, mais de types très différents5,10. Aussi longtemps qu’elles le peuvent, ces cellules délivrent suffisamment des nutriments à leur environnement (= la matrice extracellulaire), ce qui permet aux disques de continuer à fonctionner correctement.
Le gros problème est que, à partir de l’adolescence, de nombreuses cellules du noyau sont désactivées8,11. Leurs conditions de travail se compliquent progressivement, si bien qu’une grande partie d’entre elles abandonnent ou « prennent leur retraite » (= apoptose). D’autres résistent un peu plus longtemps, mais finissent par vieillir et s’user encore plus vite (= sénescence). Certaines renoncent et meurent (= nécrose)8. À cause de leur nombre en baisse, les noyaux ne disposent plus d’assez de fibres de collagène élastique (type 2), mais également de protéoglycanes12,13. La réduction de ce type de cellules ne perturbe donc pas seulement les fonctions du disque, mais également la manière dont ils vieillissent.
Après 15 ans, l’alimentation du disque est aussi perturbée
À partir de l’âge de 15 ans, tous les vaisseaux sanguins acheminant le sang vers les disques sont interrompus. Au niveau des plaques terminales (la « frontière » entre vertèbres et disques), la nature a créé un mur calcifié presque impénétrable14. Étant donné que les fibres de collagène de type 2 (élastiques) se déforment sous la pression, les plaques terminales perdent de leur flexibilité et peuvent se rompre prématurément face aux charges du quotidien. Ceci constitue une des causes probables de l’apparition de douleurs aiguës dans le bas du dos.
Dans notre corps, toutes les cellules ne sont pas égales face aux « lois de la nature »
À l’école, nous avons appris que nos 100 000 milliards de cellules doivent être fournies en sang pour pouvoir assurer normalement leurs fonctions. Les cellules doivent continuellement recevoir les nutriments nécessaires (entre autres l’oxygène et les glucides), évacuer leurs déchets en permanence (entre autres le dioxyde de carbone et l’acide lactique) et compenser tout déséquilibre dans leur métabolisme. Pour des raisons inconnues, l’évolution n’a pas assuré aux disques une bonne irrigation sanguine : c’est pourquoi ils s’usent prématurément.
Après 15 ans, la situation est de plus en plus difficile pour les cellules restantes dans le disque
À partir de l’âge de 15 ans, les activités métaboliques des noyaux discaux sont fortement entravées15,16,17. Étant donné que l’acide lactique est moins bien évacué et que les déchets s’accumulent, le milieu des cellules discales s’acidifie (= ph bas). Les cellules les plus fortes, les plus résistantes adaptent leur machinerie moléculaire. Elles continuent d’effectuer au mieux les mécanismes métaboliques complexes18,19,20,21.
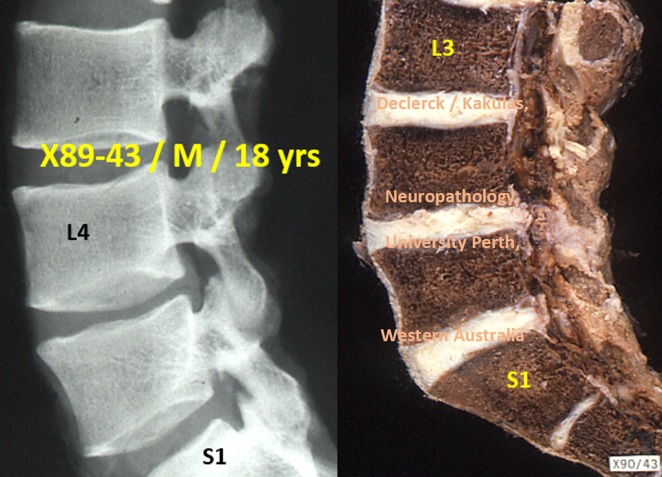
À 18 ans, les corps vertébraux ont presque leur forme définitive. Les délimitations entre les trois parties du disque sont de moins en moins visibles. À l’âge d’environ 15 ans, toutes les cellules notochordales embryonnaires ont disparu et le nombre de protéoglycanes diminue fortement. Cela fait que bien moins d’eau peut être absorbée et maintenue dans les noyaux. La porte est alors ouverte aux processus de vieillissement. Les mécanismes hydrostatiques du disque commencent alors à dérailler. Les zones autour des noyaux (= matrice extracellulaire) ressemblent peu à peu au cartilage, blanc et dur. Cela est provoqué par les protéoglycanes qui sont de plus en plus entravés par les fibres de collagène (type 2). Les noyaux perdent alors leur apparence gélatineuse transparente.
Le vieillissement du disque est inévitable
Étant donné que le processus de vieillissement entrave progressivement l’évacuation des déchets des noyaux discaux, leur composition et leur structure s’altèrent1,2,8,9a,11,22. La nature stimule les cellules restantes dans le traitement de leurs propres produits de dégradation. C’est pourquoi la production de catalyseurs destructeurs (= métalloprotéinase matricielle ou MMP) augmente. Une fois activées, ces enzymes de dégradation — et c’est surprenant — deviennent hyperactives et commencent à dégrader les protéoglycanes et le collagène de type 2 encore intacts23,24. Le noyau change alors de couleur25,26. Le processus de vieillissement entrave la production de nouveaux protéoglycanes et collagène de type 2.
Dans un article à venir, nous aborderons comment les disques vieillissants doivent adapter leur stratégie pour ralentir leur dégénérescence.
Références
1a. Bobrovskiy I, Hope JM, Ivantsov A et al., ‘Ancient steroids establish the Ediacaran fossil Dickinsonia as one of the earliest animals’, Science, 2018, 361:1246
1b. Frances Arnold - https://en.wikipedia.org/wiki/Frances_Arnold
1c. Antoniou J, Steffen T, Nelson F et al., ‘The human lumbar intervertebral disc. Evidence for changes in the biosynthesis and denaturation of the extracellular matrix with growth, maturation, ageing, and degeneration’, J Clin Invest, 1996, 98:996
2. Roughley PJ, ‘Biology of intervertebral disc aging and degeneration. Involvement of the extracellular matrix’, Spine, 2004, 29:2691
3. Lotz JC, Chin JR, ‘Intervertebral disc cell death is dependent on the magnitude and duration of spinal loading’, Spine, 2000, 25:1477
4. Kenta A, Miyamoto S, Nakase T et al., ‘The relationship between apoptosis of endplate chondrocytes and aging and degeneration of the intervertebral disc’, Spine, 2001, 26:2414
5. Oegema TR Jr, ‘The role of disc cell heterogeneity in determining disc biochemistry. A speculation’, Biochem Soc Trans, 2002, 30(Pt 6):839
6. Hsieh AH, Lotz JC, ‘Prolonged spinal loading induces matrix metalloproteinase-2 activation in intervertebral discs’, Spine, 2003, 28:1781
7. Lawrence JS, ‘Disc degeneration. Its frequency and relationship to symptoms’, Ann Rheum Dis, 1969, 28:121
8. Gruber HE, Hanley EN Jr, ’Analysis of aging and degeneration of the human intervertebral disc. Comparison of surgical specimens with normal controls’, Spine, 1998, 23:751
9a. Freemont AJ, Hoyland JA, ‘Morphology, mechanisms and pathology of musculoskeletal ageing’, J Pathol, 2007, 211:252
9b. Adams MA, Roughley PJ, ‘What is intervertebral disc degeneration, and what causes it?’ Spine, 2006,31:2151
10. Hastreiter D, Ozuna RM, Spector M, ‘Regional variations in certain cellular characteristics in human lumbar intervertebral discs, including the presence of alpha-smooth muscle actin’, J Orthop Res, 2001, 19:597
11. Buckwalter JA, ‘Aging and degeneration of the human intervertebral disc’, Spine, 1995, 20:1307
12. Singh K, Masuda K, Thonar EJMA et al., ‘Age-related changes in the extracellular matrix of nucleus pulposus and anulus fibrosus of human intervertebral disc’, Spine, 2009, 34:10
13. Iatridis JC, Laible JP, Krag MH, ‘Influence of fixed charge density magnitude and distribution on the intervertebral disc. Applications of a poroelastic and chemical electric (PEACE) model’, J Biomech Eng, 2003, 125:12
14. Moore RJ, ‘The vertebral end-plate. What do we know?’, Eur Spine J, 2000, 9:92
15. Maroudas A, Stockwell RA, Nachemson A, Urban J, ‘Factors involved in the nutrition of the human lumbar intervertebral disc. Cellularity and diffusion of glucose in vitro’, J Anat, 1975:113
16. Urban JP, Holm S, Maroudas A, et al., ‘Nutrition of the intervertebral disk. An in vivo study of solute transport’, Clin Orthop Relat Res, 1977, 129:101
17. Stairmand JW, Holm S, Urban JP, ‘Factors influencing oxygen concentration gradients in the intervertebral disc. A theoretical analysis’, Spine, 1991, 16:444
18. Horner HA, Urban JP, '2001 Volvo Award Winner in Basic Science Studies. Effect of nutrient supply on the viability of cells from the nucleus pulposus of the intervertebral disc’, Spine, 2001, 26:2543
19. Selard E, Shirazi-Adl A, Urban JP, ‘Finite element study of nutrient diffusion in the human intervertebral disc’, Spine, 2003, 28:1945
20. Ferguson SJ, Ito K, Nolte LP, ‘Fluid flow and convective transport of solutes within the intervertebral disc’ J Biomech, 2004, 37:213
21. Bibby SR, Jones DA, Ripley RM et al., ‘Metabolism of the intervertebral disc. Effects of low levels of oxygen, glucose, and pH on rates of energy metabolism of bovine nucleus pulposus cells’, Spine, 2005, 30:487
22. Urban JP, Roberts S, ‘Degeneration of the intervertebral disc’, Arthritis Res Ther, 2003, 5:120
23. Handa T, Ishihara H, Ohshima H et al., ‘Effects of hydrostatic pressure on matrix synthesis and matrix metalloproteinase production in the human lumbar intervertebral disc’, Spine, 1997, 22:1085
24. Willett TL, Labow RS, Lee JM, ‘Mechanical overload decreases the thermal stability of collagen in an in vitro tensile overload tendon model’, J Orthop Res, 2008, 26:1605
25. Hormel SE, Eyre DR, ‘Collagen in the ageing human intervertebral disc. An increase in covalently bound fluorophores and chromophores’, Biochim Biophys Acta, 1991, 1078:243
26. Nerlich A, Schleicher ED, Boos N, ‘Immunohistologic markers for age‐related changes of human lumbar intervertebral discs. 1997 Volvo Award Winner in Basic Science Studies’, Spine 1997, 24:2781
* Guy Declerck, MD
. 1964, Grieks-Latijnse Humaniora
. 1978, Dokter in de Genees-,Heel-, en Verloskunde (KUL)
. 1983, Medische Specialist in de Orthopedie (KUL & Exeter, UK)
. 1988, Postgraduate Orthopedic Surgery (Plymouth & Liverpool, UK)
. 1989, Spinal Fellow in Adult Spinal Surgery (Perth, Australia)
. 1989, Research Fellow in Spinal Injuries & Rehabilitation (Perth, Australia)
. 1989, Neuromuscular Foundation of Western Australia Postgraduate Studentship
. 1992, Spinaal Orthopedisch Chirurg (Vlaanderen en buitenland)
. 1992, Medical Doctor National Belgian Judo Team
. 1993, European Spine Research Fellowship ‘Bionic Walking’ (Stoke-on-Trent, UK)
. 1994, Worldwide Encyclopaedia Invited Surgeon and SAFIR Spinal Travel Fellowship
. 2003, Rugchirurg-op-rust in Vlaanderen
. 2003-2006, Sabbatical
. 2007-2014, International Spinal Research, Spinal Scientific Advisory Consultant & Instructor
. 2007-now, Consultant Research & Development Innovative & Restorative Spinal Technologies
. 2007-now, Spinal Lecturing & Writing, Surgical Education (www.guy-declerck.com en www.hhp.be/nl/blog)
. 2012-now: President International Association Andullation Therapy (www.iaat.eu)











Réactions