Mysterie van discuskraakbeen
Ter vergelijking: eenvormig gestructureerd kraakbeen in alle gewrichten
De gewrichten van knie, elleboog, heup, schouder, handen en voeten kunnen normaal gezien gedurende zeer lange periodes probleemloos bewegen. Een belangrijke reden hiertoe is het feit dat deze gewrichten over slechts één bepaalde soort kraakbeen beschikken waarin zich één bepaalde soort kraakbeencellen bevinden die altijd dezelfde soort kraakbeeneiwitten produceren. Dit kraakbeen blijft normalerwijze lange tijd soepel en buigzaam genoeg om dagelijkse lasten op te vangen. Zelfs verouderingsverschijnselen worden slechts op oudere leeftijd ervaren (zie Blog ‘Artrose in armen en benen. Wat we allemaal eigenlijk zouden moeten weten’). De medische industrie slaagt er inmiddels vrij goed in dit type gewichtsdragend kraakbeen te vervangen. Maar de prothesen laten het toch nog vroeg of laat afweten omdat de biomechanische kenmerken van voorlopig gebruikte materialen, zoals polyethyleen en keramiek, niet compatibel zijn met die van het normale eenvormig kraakbeen dat vervangen wordt.
Het kraakbeen in de discus is veel complexer
De discus bestaat uit drie compleet verschillende onderdelen: (a) de eindplaten, (b) de kern en (c) de buitenring als sterkste onderdeel (Fig. 1). Elk onderdeel bevat eigen typische cellen die elk hun eigen type en hoeveelheid kraakbeeneiwitten vormen. Elk onderdeel bevat dus, naast verschillende hoeveelheden water, verschillende concentraties collagene eiwitten en suiker-eiwitverbindingen (cf. volgende blogs). Daarom wordt elk onderdeel gekenmerkt door een eigen biomechanische functie1,2,3.
Het kraakbeen in de discus is dus helemaal niet eenvormig. De grote hoeveelheid verschillende eiwitten zijn medeverantwoordelijk voor de discusfuncties. De medische industrie is er nog helemaal niet in geslaagd deze ingewikkelde en continu veranderende biomechanische structuur na te bootsen.
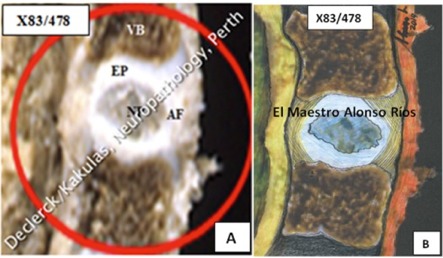
Fig. 1. Links (A): X83-478 (Declerck / Kakulas, Neuropathology, Perth, Western Australia), rechts (B): idem – illustratieve schets door de Colombiaanse beeldhouwer, tekenaar en schilder Alonso Ríos, www.alonsoriosescultor.com.
Bij dit éénjarig kindje is de vrij kleine kern (NP of nucleus pulposus) ook niet volledig centraal gelegen. Hij wordt omzoomd door bovenste en onderste eindplaten (EP) en door een dikkere en veel sterkere ligamentaire buitenring (AF of annulus fibrosus). Deze AF is voor het grootste deel vastgehecht aan de buitenzijde van wervellichamen (cf. Blog ‘Wervellichaam’). De aanpalende wervellichamen (VB = vertebral body) worden boven- en onderaan van de kern gescheiden door zeer dunne (maximaal 0,6 mm) en buigzame platen die men eindplaten noemt (EP). Vanaf de leeftijd van ongeveer 16 jaar zijn twee van deze drie elementen (eindplaten en kern) reeds vroegtijdig onderworpen aan verouderingsprocessen. De AP houdt wat langer stand.
De discus veroudert reeds vanaf de leeftijd van 16 jaar
De discus is het menselijke orgaan dat als eerste zeer vroeg veroudert. Wanneer men bij overledenen discussen in de lage rug onderzoekt, zijn er rond de leeftijd van ongeveer 20 jaar reeds bij iedereen duidelijke veranderingen zichtbaar4,5,6. Is men bovendien behept met één of meerdere slijtagegenen, dan loopt men extra risico dat discussen ook vroeg beginnen te degenereren7. Als enig zoogdier rechtoplopen, is dus een maatje te veel voor veel cellen in de discus. Mochten bepaalde discuscellen het ganse leven aanwezig blijven dan zou de discus veel makkelijker weerstand kunnen bieden aan dagelijkse rek- en drukkrachten en zou dit mensen veel rugmiserie kunnen besparen. Afgezien van enkele soorten, hebben weinig vierpoters problemen in hun discussen.
De wervelzuil wordt steeds minder beweeglijk
Naarmate we ouder worden, neemt de beweeglijkheid van de wervelzuil gestaag af. Zowel vooroverbuigen als achteroverbuigen daalt met ongeveer 20 % tussen de leeftijd van 20 tot 50 jaar8,9,10. Dit heeft weinig te maken met het beenweefsel in de wervellichamen, de collageenvezels in de ligamenten of spieren. De verminderende beweeglijkheid hangt vooral af van de verminderende kwaliteit van discussen.
Tot +/- 15 jaar gedraagt de discuskern zich voorbeeldig
Tot de leeftijd van maximaal 15 jaar bevat de kern van de discus bijzondere cellen, de notochordale cellen. Deze cellen houden slijtage tegen. Tot die leeftijd staan ze in voor een constante productie van suikereiwitmoleculen (= proteoglycanen) die nodig zijn om continu water aan te trekken en vast te houden11,12. Een hoog watergehalte is essentieel voor de discusfunctie. Hierdoor kan de kern tijdens alle dagelijkse activiteiten min of meer zijn rugbybalvormige contouren behouden of snel herstellen. Hierdoor wordt ook het normale dag- en nachtritme van de discus gevrijwaard (zie Blog ‘Het dag- en nachtritme van de discus’).
Tot ongeveer 15 jaar kunnen de kernen dan ook best vergeleken worden met sponsen vol water. Daar water niet samendrukbaar is, kan de kern niet samengedrukt worden. Maar omdat de kern wél wat elastische collagenen bezit, kan hij van vorm veranderen. Zolang de notochordale cellen hun functie perfect uitvoeren, zal men niet gauw langdurige lage rugpijn ervaren. Mocht de lasten te wijten zijn aan spierpijn, dan recupereert men zeer snel gezien spieren over een uitstekende bloedvoorziening beschikken.
Vanaf +/- 15 jaar is het mooie liedje van de kern uit!
Volhouden en doorzetten is weinigen gegeven. Ook de discuskern kan zijn functie niet lang op een perfecte manier blijven uitvoeren. De notochordale cellen verdwijnen omdat ze niet meer aan hetzelfde tempo willen en kunnen doorwerken. Ze beschikken niet over natuurlijke capaciteiten om aanhoudende dagelijkse lasten tijdens zitten, staan, lopen, sporten, springen, dansen, buigen, heffen en werken te blijven opvangen. Ze geven gewoon op! Ze verdwijnen (‘apoptosis’), verouderen zeer snel (‘senescentie’) of sterven af (‘necrose’). Dit proces is een soort voorloper van hetgeen de meeste mensen later zelf tijdens hun eigen loopbaan zullen ondervinden! Traag maar zeker en in alle stilte!
Omdat deze notochordale cellen op de leeftijd van 15 jaar bij iedereen verdwenen zijn, worden er minder suikereiwitten aangemaakt waardoor dan ook het watergehalte in de kern niet meer op peil gehouden wordt13. De verdwijnende notochordale cellen worden weliswaar vervangen, maar door een soort dat lijkt op normale kraakbeenvormende cellen (= ‘chondrocyte-like cells’). Probleem is dat deze cellen dan een verdedigende houding aannemen. Ze produceren veel taaiere type I collagenen (Fig. 2). De discus wordt almaar stijver en kwetsbaarder. Er kunnen steeds meer letsels optreden11,12.
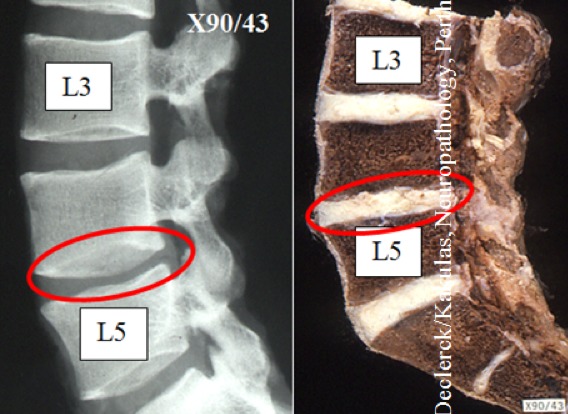
Fig. 2. X89-43 (Declerck / Kakulas, Neuropathology, Perth, Western Australia). Links: klassiek radiologisch beeld van een lage rug bij een 18-jarige man waarop geen specifieke abnormaliteiten waarneembaar zijn. De drie onderdelen van de discus zijn niet langer van elkaar te onderscheiden. Rechts: sagittale doorsnede van dezelfde wervelzuil. De kern die reeds voor het grootste deel vervangen werd door hardere collageenvezels (type I) is niet meer te onderkennen van de ligamentaire buitenband die bijna uitsluitend bestaat uit collageenvezels type I).
De discus krimpt als een uitdrogende pudding
Door de productie van collagenen (type I) en het almaar toenemend waterverlies zal de initieel geleiachtige en waterige kern (Fig. 1) indikken, droger worden en veranderen in een harder (fibreus) littekenweefsel (Fig. 2). Door deze verandering gaat de kern steeds meer lijken op de structuur van de buitenring (AF) die hoofdzakelijk opgebouwd is uit collagene eiwitten (type 1). Het voelt bijna aan als een knie- of Achillespees: taai!
Door deze verandering van een waterige naar een taaiere structuur, gaat de kern in toenemende mate verbrokkelen14. Men kan deze evoluerende uitdroging vergelijken met een pudding die te lang bewaard wordt, uitdroogt en barsten gaat vertonen. Dit natuurlijk evoluerend proces dat bijna bij iedereen voorkomt, verloopt weliswaar over jaren (Fig. 3).
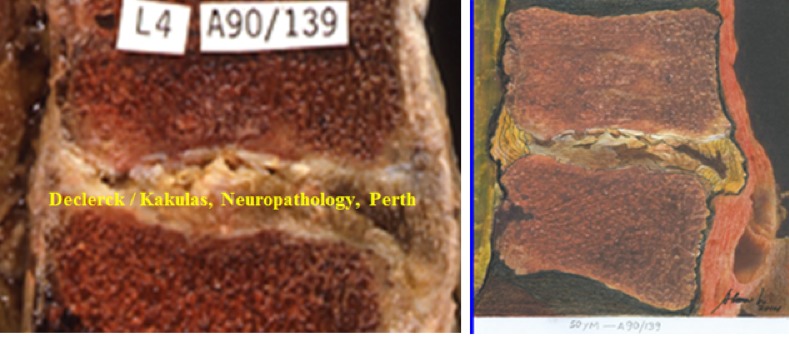
Fig. 3. Klassiek beeld van de discus op 50-jarige leeftijd. Links: A90/139 (Declerck / Kakulas, Neuropathology, Perth, Western Australia), rechts: idem – illustratieve schets door de Colombiaanse beeldhouwer, tekenaar en schilder Alonso Ríos, www.alonsoriosescultor.com. De discus van deze 50-jarige man ziet eruit als een uitgedroogde pudding. Het water is uit de kern verdwenen, waardoor de rugbyvormige structuur ervan ook niet meer zichtbaar is. Het onderscheid met de omringende buitenring is verdwenen. De kern lijkt op oud (bruine kleur) en droog littekenweefsel. De bovenste eindplaat vertoont op meerdere plaatsen onderbrekingen (breuken). De onderste eindplaat is minder erg aangetast.
Wat met de buitenring en de eindplaten?
De buitenring (AF) bevat geen notochordale cellen. Vanaf zijn vorming bevat de AF ook weinig kraakbeenvormende cellen, maar ze zijn wel taai. Ze zorgen ervoor dat de ringstructuur vanaf de leeftijd van 15 jaar weinig verandert. De cellen van de buitenring blijven altijd sterke collagene eiwitten (type 1) produceren. Door het vroegtijdige verouderingsproces verminderen wel de hoeveelheden suikereiwitten en water. De buitenring wordt harder (Fig. 3).
Het kraakbeen ter hoogte van de eindplaten (EP) verandert sneller, wordt harder, verliest meer en meer zijn elasticiteit en gaat steeds meer lijken op het hardere en eenvormige kraakbeen dat men aantreft in heupen en knieën. Omdat het zeer dun is (ongeveer 0,6 mm), kunnen er makkelijk breuken ontstaan (Fig. 3).
De discus is het enige lichaamsorgaan met een slechte bloedsvoorziening
De discus is het enige orgaan dat bijna geen bloedvoorziening bezit. Geen enkel bloedvat dringt door tot in de centrale kern15,16,17,18,19,20. De enkele fijne bloedvaatjes bevinden zich uitsluitend in het midden van de bovenste en onderste dekplaten (EP) en aan de buitenzijde van de buitenring (AF) waarin ze slechts over een bijzondere kleine afstand kunnen doordringen (Fig. 4).
Zonder bloedvoorziening beschikt geen enkel orgaan over mogelijkheden om te genezen indien er zich problemen voordoen.
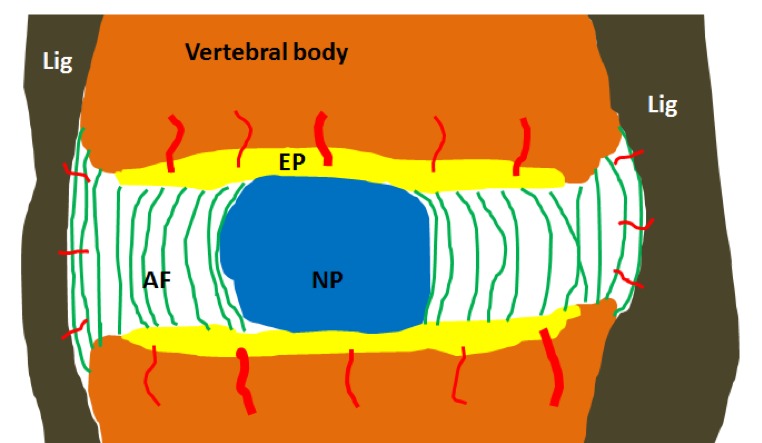
Fig. 4. De discus is het enige orgaan dat bijna geen bloedvoorziening bezit. Op deze schematische voorstelling stellen de rode lijntjes de enkele fijne bloedvaatjes voor die zich uitsluitend in het midden van de bovenste en onderste dekplaten (EP) bevinden en aan de buitenzijde van de buitenring (AF), waarin ze slechts over een uiterst kleine afstand doordringen.
Geen bloedvoorziening, dus weinig voedsel!
De voeding van de kern, d. w. z. de aanvoer van voedingsstoffen (zuurstof en suiker) en de afvoer van afvalstoffen (melkzuur en koolstoffen), gebeurt via zeer ingewikkelde fysische wetmatigheden, ‘diffusie’ en ‘osmose’ genaamd.
De mate waarin de buitenring en de eindplaten van bloed voorzien worden (Fig. 4), is sterk afhankelijk van de enorme mechanische lasten die de discus moet torsen tijdens zitten, staan, stappen, buigen enz. Wanneer de discus intenser belast wordt, komt zijn reeds geringe bloedvoorziening nog meer onder druk te staan en geschieden de nodige stofuitwisselingen nog trager21,22. De natuur heeft de discus niet voorzien van normale verdedigingssystemen. Wanneer de discus minder belast wordt tijdens platte rust, dan geschiedt de bloedvoorziening gemakkelijker. Eigenaardig, want rust roest!
De discus is vroeger onderhevig aan burn-out dan zijn gastvrouw of gastheer
Omdat de discus, in tegenstelling tot andere lichaamsorganen, moeite heeft zich normaal te voeden en veel te vroeg veroudert, kunnen de verschillende soorten kraakbeen in zijn drie onderdelen vanaf de leeftijd van ongeveer 15 jaar de ‘druk’ niet meer aan. Ze blijven niet ongestraft alle belastingen opvangen. Elk van deze onderdelen wordt veel te snel vermoeid.
‘Fatigue failure’ is typisch voor de discus (Fig. 3)
Het mechanische fenomeen waarbij om het even welke structuur faalt wanneer het moe wordt, noemt men ‘fatigue failure’23. Er ontstaan meerdere microscopische letseltjes tot het geheel gaat scheuren of in elkaar storten.
Een typisch voorbeeld is metaalmoeheid waardoor een metalen hijskraan plots en zonder duidelijke reden ineenstort. Ingenieurs kunnen dit voorkomen24. Maar ’t zal nog een tijdje duren vooraleer dit kan gerealiseerd worden voor de discus. De geneeskunde vertoont geen interesse in de discusproblemen. Liever weg ermee... Dus wegsnijden (zie blog: ‘ Discusproblemen! Wie heeft daar nu interesse voor?)!
‘Fatigue failure’ is ook de reden van overbelastingsletsels bij atleten. De discus krijgt echter nooit rust. Hij moet doorgaan met al zijn activiteiten en ondergaat zelfs in rusttoestand de last van de zwaartekracht. De discus krijgt niet de tijd om perfect te genezen.
De discus kan zichzelf bijna niet genezen
Wanneer er letsels optreden of scheuren ontstaan in één of meerdere van de drie discusonderdelen, kunnen die zeer moeilijk genezen. Dit is niet enkel te wijten aan het feit dat de discus continu belast wordt en over een geringe bloedvoorziening beschikt, maar ook omdat elk soort kraakbeen een geringe hoeveelheid cellen bevat.
Treedt er een scheur op in de kern, dan zal dit zelfs leiden tot meer afbraak van de suikereiwitmoleculen en de fijne collageenvezels21.
Wordt de buitenring gekwetst, dan kunnen de collageenvezels ervan zich niet spontaan herstellen of zich opnieuw vormen22. Het genezingsproces wordt verder verhinderd doordat er in de letsels en scheuren ook ontstekingscellen verschijnen die deze letsels en scheuren zelfs vergroten23,24.
Discusletsels veroorzaken niet noodzakelijk pijn
In de embryonale fase van de lichaamsvorming wordt bijna elk bloedvaatje vergezeld door een zenuwvezeltje. Gezien de bijzondere locatie van de fijne bloedvaatjes in de discus (zie hoger), zijn er dus ook slechts weinig zenuwtjes aanwezig ter hoogte van de buitenring en de eindplaten25,26,27. Een normale discus kan dus in principe weinig alarmsignalen uitzenden wanneer er in die twee discusonderdelen problemen optreden.
Wat gebeurt er indien een letsel, scheur of breuk moet genezen?
Kenmerkend voor alle genezingsprocessen is dat er in de letsels en wonden bloedvaatjes ingroeien. Ze voeren tal van cellen mee zodat de abnormaliteit eerst opgevuld wordt met genezingsweefsel. Dit wordt dan omgevormd tot nieuw weefsel dat doorgaans lijkt op het oorspronkelijke. Kijkt u maar even naar een litteken op uw arm of been. Het is zeer vermoedelijk geen normale huid. Soms kunnen die ingroeiende bloedvaatjes vergezeld zijn van pijngevoelige zenuwvezeltjes waardoor het litteken ‘gevoelig’ blijft.
De discus kan pijn doen als gevolg van genezing van zijn letsels
Wanneer de drie discusonderdelen door accident gekwetst worden of tijdens verouderings- of slijtageprocessen meer gaan scheuren of ‘burn-out’ letseltjes veroorzaken, zullen bloedvaatjes die zich aan de buitenzijde of ter hoogte van de eindplaten bevinden (Fig. 1), proberen binnen te dringen. Ze zullen er proberen litteken te vormen (wat niet altijd lukt!). Wanneer deze bloedvaatjes ook vergezeld worden van pijngevoelige zenuwvezeltjes, dan kunnen deze plaatsen ook pijngevoelig blijven. De ‘genezen’ discus blijft dan ook gevoelig voor pijn27,28,29,30,31,32,33.
Omdat de discus nooit kan rusten, kunnen de vele dagelijkse activiteiten deze pijnvezeltjes in het litteken irriteren en zo af en toe of altijd pijn opwekken. Dit is slechts één van de mogelijke verklaringen waarom iemand die chronische lage rugpijn heeft ook nog af en toe een scherpe pijnscheut kan ervaren bij zelfs ‘banale’ activiteiten waarbij het pijngevoelig litteken belast wordt.
In de volgende blogs…
Elk van de drie discusonderdelen in de lage rug kan de oorzaak vormen voor het ontstaan van lage rugpijn. In de volgende blogs worden enkele details uitgelegd over de normale structuur van de kern, buitenring en eindplaten, maar ook wat er gebeurt tijdens de processen van veroudering en degeneratie.
Referenties
1 Setton LA, Chen J, ‘Cell mechanics and mechanobiology in the intervertebral disc’,
Spine, 2004, 29:2710
2 Clouet J, Grimandi G, Pot-Vausel M et al., ‘Identification of phenotypic discriminating markers for intervertebral disc cells and articular chondrocytes’,
Rheumatology (Oxford), 2009, 48:1447
3 Adams MA, Bogduk N, Burton K, Dolan P (eds), ‘The Biomechanics of Back Pain. 3the Edition’,
Edinburgh, Churchill Livingstone, 2013
4 Miller JA, Schmatz C, Schultz AB, ‘Lumbar disc degeneration. Correlation with age, sex, and spine level in 600 autopsy specimens’,
Spine, 1988, 13:173
5 Boos N, Weissbach S, Rohrbach H et al., ‘Classification of age-related changes in lumbar intervertebral discs. 2002 Volvo Award in basic science’,
Spine, 2002, 27:2631
6 Haefeli M, Kalberer F, Saegesser D et al., ‘The course of macroscopic degeneration in the human lumbar intervertebral disc’,
Spine, 2006, 31:1522
7 www.guy-declerck.com / Degenerative Discogenic Syndrome / Genetics
8 Burton AK, Tillotson KM, ‘Reference values for 'normal' regional lumbar sagittal mobility’,
Clin Biomech, 1988, 3:106
9 Sullivan MS, Dickinson CE, Troup JD, ‘The influence of age and gender on lumbar spine sagittal plane range of motion. A study of 1126 healthy subjects’,
Spine, 1994, 19:682
10 Bible JE, Simpson AK, Emerson JW et al., ‘Quantifying the effects of degeneration and other patient factors on lumbar segmental range of motion using multivariate analysis’,
Spine, 2008, 33:1793
11 Trout JJ, Buckwalter JA, Moore KC et al., ‘Ultrastructure of the human intervertebral disc. I. Changes in notochordal cells with age’,
Tissue Cell, 1982, 14:359
12 Kim KW, Lim TH, Kim JG et al., ‘The origin of chondrocytes in the nucleus pulposus and histologic findings associated with the transition of a notochordal nucleus pulposus to a fibrocartilaginous nucleus pulposus in intact rabbit intervertebral discs’,
Spine, 2003, 28:982
13 Boos N, Weissbach S, Rohrbach H et al., ‘Classification of age-related changes in lumbar intervertebral discs. 2002 Volvo Award in basic science’,
Spine, 2002, 27:2631
14 Adams MA, Dolan P, Hutton WC, ‘The stages of disc degeneration as revealed by discograms’,
J Bone Joint Surg, 1986, 68B:36
15 Buckwalter JA, ‘Aging and degeneration of the human intervertebral disc’,
Spine, 1995, 20:1307
16 Ishihara H, McNally DS, Urban JP et al. , ‘Effects of hydrostatic pressure on matrix synthesis in different regions of the intervertebral disk’,
J App Physiol, 1996, 80:839
17 McMillan DW, Garbutt G, Adams MA, ‘Effect of sustained loading on the water content of intervertebral discs. Implications for disc metabolism’,
Ann Rheum Dis, 1996, 55:880
18 Urban JP, Roberts S, ‘Degeneration of the intervertebral disc’,
Arthritis Res Ther, 2003, 5:120
19 Roughley PJ, ‘Biology of intervertebral disc aging and degeneration. Involvement of the extracellular matrix’,
Spine, 2004, 29:2691
20 www.guy-declerck.com / Lumbar intervertebral disc / Nutrition of an inhospitable environment
21 Melrose J, Ghosh P, Taylor TK et al., ‘A longitudinal study of the matrix changes induced in the intervertebral disc by surgical damage to the annulus fibrosus’,
J Orthop Res, 1992, 10:665
22 Arun R, Freeman BJ, Scammell BE et al., ‘2009 ISSLS Prize Winner. What influence does sustained mechanical load have on diffusion in the human intervertebral disc? An in vivo study using serial postcontrast magnetic resonance imaging’,
Spine, 2009, 34:2324
23 Adams MA, Bogduk N, Burton K, Dolan P (eds), ‘The Biomechanics of Back Pain. 3the Edition’,
Edinburgh, Churchill Livingstone, 2013:7
24 Koyama M, Zhang Z, Wang M et al., ‘Bone-like crack resistance in hierarchical metastable nanolaminate steels’,
Science, 2017, 355:1055
25 Hampton D, Laros G, McCarron R et al., ‘Healing potential of the anulus fibrosus’,
Spine, 1989, 14:398
26 Osti OL, Vernon-Roberts B, Fraser RD, ‘1990 Volvo Award in Experimental Studies. Anulus tears and intervertebral disc degeneration. An experimental study using an animal model’,
Spine, 1990, 15:762
27 Kanerva A, Kommonen B, Grönblad M et al., ‘Inflammatory cells in experimental intervertebral disc injury‘,
Spine, 1997, 22:2711
28 Rabischong P, Louis P, Vignaud J et al., ‘Le disque intervertébral’,
Anat Clin, 1978, 1:55
29 Yoshizawa H, O’Brien JP, Smith WT et al., ‘The neuropathology of intervertebral discs removed for low-back pain’,
J Path, 1980, 132:96
30 Coppes MH, Marani E, Thomeer RT, et al., ‘Innervation of "painful" lumbar discs’,
Spine, 1997,22:2342
31 Freemont AJ, Peacock TE, Goupille P et al., ‘Nerve ingrowth into diseased intervertebral disc in chronic back pain’,
Lancet, 1997, 350:178
32 Brown MF, Hukkanen MV, McCarthy ID et al., ‘Sensory and sympathetic innervation of the vertebral endplate in patients with degenerative disc disease’,
J Bone Joint Surg, 1997, 79B:147
33 Peng B, Hao J, Hou S et al., ‘Possible pathogenesis of painful intervertebral disc degeneration’,
Spine, 2006, 31:560












DISCUSSIE