Le mystère du cartilage discal
En comparaison : le cartilage homogène de la plupart des articulations
En temps normal, les articulations des genoux, coudes, hanches, épaules, mains et pieds peuvent se mouvoir sans problème, et ce durant de longues périodes. Une des raisons principales est que ces articulations se composent d’un seul type de cartilage, c.-à-d. d’un seul type de cellule de cartilage produisant un seul type de protéines de cartilage. En temps normal, ce cartilage reste assez souple et flexible que pour endurer les charges du quotidien. Même les affections liées à la vieillesse ne se déclarent habituellement qu’à un âge avancé (voir article « Arthrose des bras et jambes : ce que nous devrions tous savoir »). L’industrie médicale a d’ailleurs réussi à remplacer avec succès ce type de cartilage. Il est néanmoins vrai que les prothèses installées finissent tôt ou tard par causer des problèmes, le polyéthylène et la céramique n’étant pas compatibles avec le cartilage homogène qu’ils remplacent.
Le cartilage des disques est bien plus complexe
Le disque se compose de 3 parties complètement différentes : (a) les plaques terminales, (b) le noyau et (c) l’anneau externe, la partie la plus solide (Fig. 1). Chacune de ces parties contient des cellules produisant leur propre type de protéines de cartilage. Chaque partie contient donc, en plus des différentes teneurs en eau, différentes concentrations de protéines de collagène et de glycoprotéines. C’est pourquoi chaque partie possède une fonction biomécanique qui lui est propre1,2,3. Le cartilage du disque n’est donc pas du tout homogène. La grande quantité de protéines différentes assure ensemble les fonctions du disque. L’industrie médicale n’est cependant toujours pas capable d’imiter cette structure biomécanique complexe et changeante.
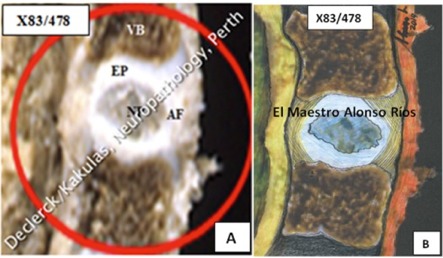
Fig. 1 ; Gauche (A) : X83-478 (Declerck / Kakulas, Neuropathology, Perth, Western Australia), droite (B) : idem – esquisse par le sculpteur, dessinateur et peintre colombien Alonso Ríos - www.alonsoriosescultor.com. Chez cet enfant de 1 an, le noyau (assez petit) ne situe pas tout à fait au centre. Il est délimité par les plaques terminales supérieure et inférieure, ainsi que par un anneau externe fibreux, bien plus coriace. La majorité de l’anneau est rattaché à la couche externe du noyau (voir article « Le corps vertébral »). Les corps vertébraux adjacents situés au-dessus et en dessous du noyau en sont séparés par de fines plaques (maximum 0,6 mm) flexibles appelées plaques terminales. À partir de l’âge de 16 ans, deux de ces trois éléments (plaques terminales et noyau) sont déjà sujets à des processus de vieillissement. L’anneau résiste plus longtemps.
Le disque commence à vieillir dès l’âge de 16 ans
Le disque est l’organe humain qui vieillit le plus vite. Lorsqu’on procède à des dissections post-mortem de disques du bas du dos, il y a, vers l’âge d’environ 20 ans, des altérations clairement visibles chez presque tout le monde4,5,6. Si, en plus, on a hérité d’une ou plusieurs « gènes d’usure », on court des risques supplémentaires de dégénérescence prématurée et accélérée des disques7. Seul mammifère se déplaçant sur deux pattes, l’homme doit composer avec des disques confrontés à d’intenses charges. Si les cellules du disque duraient toute notre vie, notre disque serait à même de résister aux différentes tensions et charges qui s’exercent sur lui au quotidien, ce qui nous éviterait de nombreux problèmes dorsaux. À quelques exceptions près, les quadrupèdes ne présentent pas de problèmes de disque.
La colonne vertébrale perd peu à peu sa mobilité
À mesure que l’on vieillit, la mobilité de la colonne vertébrale diminue. Se pencher, autant vers l’avant que l’arrière, est un mouvement qui se voit entravé d’environ 20% entre l’âge de 20 et 50 ans8,9,10. Cela a moins à voir avec l’os du corps vertébral ou les fibres de collagène des ligaments et muscles. La perte de mobilité découle souvent de disques dont la qualité diminue.
Jusqu’à 15 ans, les noyaux discaux sont parfaits
Jusqu’à l’âge de 15 ans, le noyau du disque contient des cellules particulières : les cellules notochordales, qui ralentissent la dégradation naturelle. Jusqu’à cet âge, elles sont responsables de la production constante de protéoglycanes, nécessaires pour capturer l’eau environnante et la maintenir au sein du noyau11,12. Un taux d’eau élevé est donc essentiel pour que le disque fonctionne correctement. Cela permet au noyau de garder – ou rapidement retrouver – sa forme de ballon de rugby en se gonflant d’eau. Ceci permet également de préserver le rythme jour-nuit normal du disque (voir article « Le rythme jour-nuit du disque intervertébral »). Jusqu’à environ 15 ans, les noyaux peuvent être comparés à des éponges pleines d’eau. L’eau n’étant pas compressible, les noyaux ne le sont pas non plus. Mais vu que les noyaux sont constitués de fibres de collagène élastiques, ils peuvent se déformer. Tant que les cellules notochordales assurent leur fonction normalement, les douleurs lombaires sont très peu probables. Si les douleurs ont une origine musculaire, elles sont vite résorbées car les muscles bénéficient d’un important apport sanguin.
Passé 15 ans, les noyaux commencent à se dégrader
La persévérance est une qualité assez rare. C’est aussi le cas pour les noyaux discaux, qui ne peuvent pas éternellement assurer leur fonction de façon optimale. Les cellules notochordales disparaissent car elles sont incapables de continuer à travailler au même rythme. Elles ne disposent pas d’une capacité de résistance naturelle, qui lui permettrait de faire face aux charges des mouvements du quotidien, tels que s’asseoir, se tenir debout, faire du sport, sauter, danser, se pencher, tirer et travailler. Elles finissent par laisser tomber ! Elles disparaissent (« apoptosis »), vieillissent rapidement (« sénéscence ») ou finissent par mourir (« nécrose »). Ce processus est en quelques sortes un précurseur de phénomènes qui surviendront plus tard dans leur vie. Doucement mais sûrement, et surtout silencieusement ! Étant donné que ces cellules notochordales ont disparu aux alentours de 15 ans, le nombre de protéoglycanes diminue et les noyaux ont plus de mal à maintenir leur concentration optimale en eau13. Les cellules notochordales disparues sont bel et bien remplacées, mais par des cellules qui ressemblent à des cellules de cartilage normal. Le problème est que ces cellules adoptent alors une position défensive. Elles produisent des fibres de collagène type I (Fig. 2). Le disque devient alors plus rigide et fragile. D’autres lésions sont possibles11,12.
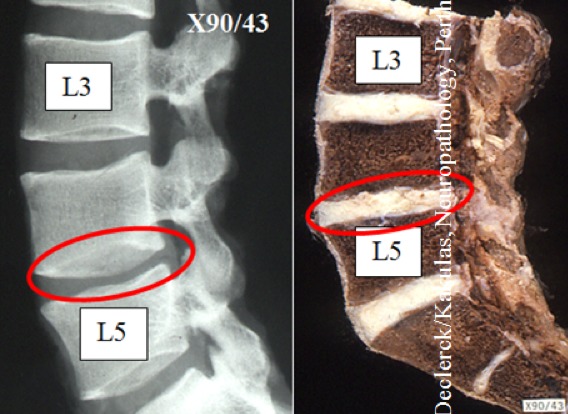
Fig. 2. X90-43 (Declerck / Kakulas, Neuropathology, Perth, Western Australia). Gauche : images radio classiques des vertèbres lombaires chez un homme de 18 ans qui ne présente aucune anomalie. Les trois parties du disque ne sont plus différenciables. Droite : coupe sagittale de la même colonne vertébrale. Le noyau a déjà été presque entièrement remplacé par de coriaces fibres de collagène (type I) et on ne peut plus le distinguer de la couche externe de ligaments composée dans sa grande majorité de fibres de collagène.
Le disque se contracte comme un flan qui sèche
La production de collagène (type I) et une concentration en eau de plus en plus faible va progressivement épaissir, assécher et transformer le noyau initialement gélatineux et plein d’eau (Fig. 1) en un amas de tissus cicatriciels (Fig. 2). Ces altérations font en sorte que les noyaux ressemblent de plus en plus à la structure de l’anneau externe constitués principalement de protéines de collagène (type I). Il devient alors très similaire à un tendon, tel que ceux du genou ou le tendon d’Achilles : très coriace ! Cette transformation, ce passage d’une structure pleine d’eau vers des tissus endurés fait que le noyau s’effrite progressivement14. On peut comparer cet assèchement progressif à un flan qui serait resté trop longtemps à l’air libre et sur lequel apparaissent des fissures. Ce processus naturel qui se déclare chez presque tout le monde, se déroule, il est vrai, sur plusieurs années (Fig. 3).
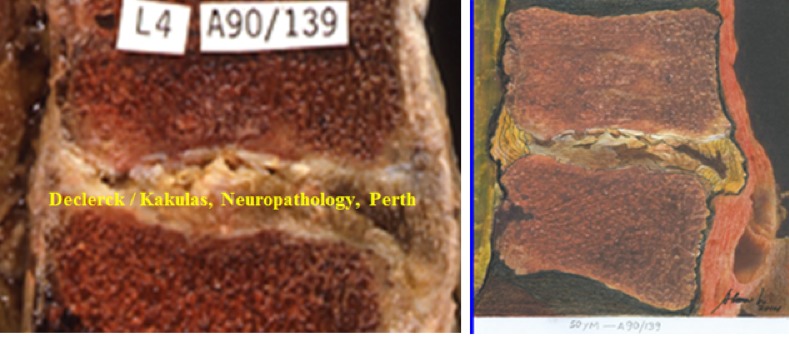
Fig. 3. Image classique d’un disque à l’âge de 50 ans. Gauche : A90/139 (Declerck / Kakulas, Neuropathology, Perth, Western Australia), droite : idem – esquisse du sculpteur, dessinateur et peintre Alonso Ríos, www.alonsoriosescultor.com. Le disque de cet homme de 50 ans ressemble à un pudding sec. L’eau a quitté le noyau, ce qui fait que sa structure en forme de ballon de rugby n’est plus visible. Le noyau ressemble à du vieux tissu cicatriciel asséché. La plaque terminale supérieure affiche des fractures à plusieurs endroits. La plaque terminale inférieure est bien moins affectée.
Qu’en est-il du noyau externe et des plaques terminales ?
L’anneau externe ne contient pas de cellules notochordales. L’anneau ne contient que peu de cellules capables de produire du cartilage, mais il est bien plus coriace. Il assure à la structure de l’anneau de peu se déformer après l’âge de 15 ans. Les cellules de l’anneau fibreux continuent de produire des protéines de collagène résistantes (type I). Le processus de vieillissement prématuré entraîne néanmoins une diminution du nombre de protéoglycanes et d’eau. L’anneau externe s’endurcit (Fig. 3). Le cartilage au niveau des plaques terminales s’altère plus vite, perd progressivement son élasticité et ressemble alors de plus en plus au cartilage dur et homogène des hanches et des genoux. Étant donné que ces plaques sont très fines (à peu près 0,6 mm), des fractures peuvent facilement apparaitre (Fig. 3).
Le disque est le seul organe qui ne bénéficie pas d’un apport sanguin suffisant
Le disque est le seul organe dépourvu de vaisseaux sanguins. En effet, ils n’arrivent pas à s’infiltrer au travers du noyau central15,16,17,18,19,20. Les quelques vaisseaux sanguins qui s’y trouvent ne sont situés qu’au centre des plaques terminales supérieures et inférieures, ainsi qu’à l’extérieur de l’anneau fibreux (Fig. 4). Sans apport sanguin, aucun organe ne peut guérir en cas de problèmes.
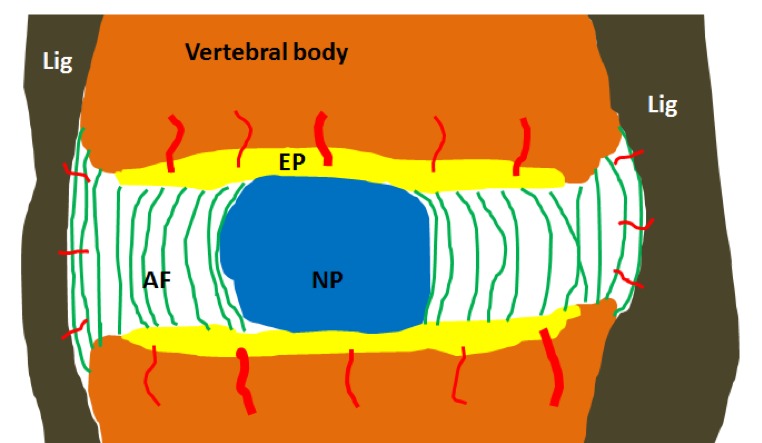
Fig. 4. Le disque est le seul organe du corps humain qui n’est (presque) pas irrigué de sang. Sur ce schéma, les lignes rouges représentent quelques vaisseaux sanguins fins qui n’atteignent que les parties supérieures et inférieures des plaques, ainsi qu’à l’extérieur de l’anneau externe, dans lequel ils ne peuvent s’infiltrer que sur de petites distances.
Pas de bon apport sanguin, donc peu de nutriments !
Le noyau est alimenté – c.-à-d. qu’il reçoit les nutriments nécessaires (oxygène et glucose) et évacue les déchets (acide lactique et carbone) – selon des lois physiques très complexes, que l’on appelle « diffusion » et « osmose ». La mesure dans laquelle l’anneau externe et les plaques terminales reçoivent du sang (Fig. 4) dépend fortement des charges mécaniques auxquelles est confronté le disque lorsque l’on s’assied, se tient debout, marche, se penche etc. Lorsque le disque est fortement sollicité, cet apport sanguin est encore plus perturbé et le transport des nutriments s’effectue encore plus lentement21,22. La nature n’a pas fourni de système de défense au disque. Lorsque que le patient se couche - et que le disque subit moins de pressions – l’apport en sang est facilité. Et c’est assez rare : en règle générale, le repos fait rouiller !
Le disque est plus vite victime de burn-out que son ou sa propriétaire
Étant donné que le disque, contrairement à d’autres organes, a des difficultés à s’alimenter normalement et vieillit bien trop tôt, les trois différents types de cartilage ne résistent plus efficacement aux charges après l’âge de 15 ans. Et ces charges ont leurs conséquences : chacune de ces parties vieillit trop rapidement.
La “rupture par fatigue”, typique du disque (Fig. 3)
Le phénomène mécanique par lequel une structure défaille car elle se fatigue est appelé « rupture par fatigue »23. Les lésions microscopiques commencent alors à s’accumuler, jusqu’à ce que l’ensemble rompe ou s’effondre. Un exemple typique est ce qu’on appelle la fatigue des métaux, par laquelle une grue en métal peut soudainement et sans raison évidente s’effondrer. Les ingénieurs arrivent heureusement à empêcher cela24, mais il faudra encore du temps avant qu’on puisse le faire pour les disques. La médecine ne témoigne pas d’intérêt dans l’étude des disques. On préfère retirer l’entièreté du problème, donc procéder à l’ablation (voir article : « Les problèmes de disques ? Qui cela intéresse-t-il ? ») ! La « rupture par fatigue » est aussi la coupable des blessures de surmenage chez les athlètes. Le disque est constamment sollicité. Il doit assurer tous ses rôles et est soumis à des charges importantes : même en position de repos il doit supporter la gravité. Il n’a donc pas assez de temps pour guérir correctement.
Le disque ne peut presque pas guérir par lui-même
Lorsque des lésions ou des cicatrices apparaissent dans une ou plusieurs des trois parties du disque, ces dernières se soignent difficilement. Cela n’est pas seulement à cause du disque qui est constamment soumis à des charges et ne reçoit pas assez de sang, mais également car chaque sorte de cartilage ne possède qu’une quantité limitée de cellules. Si des déchirures se déclarent dans les noyaux, qui elles-mêmes entraînent une dégradation des glycoprotéines et des fines fibres de collagène21. Si l’anneau externe se fragilise, les fibres de collagène ne peuvent plus spontanément guérir ou se multiplier22. Le processus de guérison est davantage entravé au niveau de ces lésions et déchirures, car des molécules inflammatoires apparaissent également23,24.
Les lésions discales n’entraînent pas forcément des douleurs
Dans sa phase embryonnaire, chaque vaisseau sanguin qui se développe s’accompagne d’une terminaison nerveuse. Étant donné localisation particulière de ces fins vaisseaux sanguins dans les disques (voir ci-dessus), un très faible nombre de terminaisons nerveuses sont présentes au niveau de l’anneau externe et des plaques terminales25,26,27. Un disque normal n’est donc pas réellement en état d’envoyer des signaux d’alarme pour un problème qui surviendrait dans ces parties.
Que se passe-t-il lorsqu’une lésion, déchirure ou fracture doit guérir ?
Caractéristique de tout processus de guérison est l’apparition de vaisseaux sanguins dans les tissus cicatriciels et blessures. Ils transportent tout un tas de cellules qui vont d’abord combler l’anormalité avec des tissus cicatriciels. Se forme alors du tissu qui ressemble un peu à du tissu normal. Si vous regardez cependant une cicatrice de plus près, elle ne semble pas vraiment constituée de peau normale. Ces vaisseaux sanguins peuvent parfois s’accompagner de nerfs, de sorte que la cicatrice reste sensible.
Le disque peut provoquer des douleurs lorsqu’il guérit
Lorsque les trois parties de notre disque sont endommagées ou s’exposent à des déchirures ou des lésions de surmenage, dû à un vieillissement ou une dégradation, les vaisseaux sanguins situés à l’extérieur des plaques terminales (Fig. 1) essayent de pénétrer à l’intérieur. Ils y formeront des cicatrices (ce qui ne fonctionne pas toujours !). Lorsque ces vaisseaux sanguins sont accompagnés de nerfs sensibles à la douleur, ces endroits du corps peuvent devenir douloureux. Le disque « guérit » reste donc sensible à la douleur27,28,29,30,31,32,33. Étant donné que le disque est constamment sollicité, de simples activités du quotidien peuvent stimuler les nerfs apparus dans les cicatrices. Il ne s’agit là que d’une des possibles explications pour lesquelles quelqu’un souffrant de douleurs lombaires est susceptible de ressentir des pics de douleurs lors d’activités « banales » lors desquelles le tissu cicatriciel est sollicité.
À venir…
Chacune des droits parties constituantes du disque lombaire est susceptible de provoquer des douleurs lombaires. Dans les articles à venir, nous aborderons des détails sur la structure normale du noyau, de l’anneau externe et des plaques terminales, mais également ce qu’il se passe en cas de vieillissement et de dégénération.
Références
1 Setton LA, Chen J, ‘Cell mechanics and mechanobiology in the intervertebral disc’, Spine, 2004, 29:2710
2 Clouet J, Grimandi G, Pot-Vausel M et al., ‘Identification of phenotypic discriminating markers for intervertebral disc cells and articular chondrocytes’, Rheumatology (Oxford), 2009, 48:1447
3 Adams MA, Bogduk N, Burton K, Dolan P (eds), ‘The Biomechanics of Back Pain. 3the Edition’, Edinburgh, Churchill Livingstone, 2013
4 Miller JA, Schmatz C, Schultz AB, ‘Lumbar disc degeneration. Correlation with age, sex, and spine level in 600 autopsy specimens’, Spine, 1988, 13:173
5 Boos N, Weissbach S, Rohrbach H et al., ‘Classification of age-related changes in lumbar intervertebral discs. 2002 Volvo Award in basic science’, Spine, 2002, 27:2631
6 Haefeli M, Kalberer F, Saegesser D et al., ‘The course of macroscopic degeneration in the human lumbar intervertebral disc’, Spine, 2006, 31:1522
7 www.guy-declerck.com / Degenerative Discogenic Syndrome / Genetics
8 Burton AK, Tillotson KM, ‘Reference values for 'normal' regional lumbar sagittal mobility’, Clin Biomech, 1988, 3:106
9 Sullivan MS, Dickinson CE, Troup JD, ‘The influence of age and gender on lumbar spine sagittal plane range of motion. A study of 1126 healthy subjects’, Spine, 1994, 19:682
10 Bible JE, Simpson AK, Emerson JW et al., ‘Quantifying the effects of degeneration and other patient factors on lumbar segmental range of motion using multivariate analysis’, Spine, 2008, 33:1793
11 Trout JJ, Buckwalter JA, Moore KC et al., ‘Ultrastructure of the human intervertebral disc. I. Changes in notochordal cells with age’, Tissue Cell, 1982, 14:359
12 Kim KW, Lim TH, Kim JG et al., ‘The origin of chondrocytes in the nucleus pulposus and histologic findings associated with the transition of a notochordal nucleus pulposus to a fibrocartilaginous nucleus pulposus in intact rabbit intervertebral discs’, Spine, 2003, 28:982
13 Boos N, Weissbach S, Rohrbach H et al., ‘Classification of age-related changes in lumbar intervertebral discs. 2002 Volvo Award in basic science’, Spine, 2002, 27:2631
14 Adams MA, Dolan P, Hutton WC, ‘The stages of disc degeneration as revealed by discograms’, J Bone Joint Surg, 1986, 68B:36
15 Buckwalter JA, ‘Aging and degeneration of the human intervertebral disc’, Spine, 1995, 20:1307
16 Ishihara H, McNally DS, Urban JP et al. , ‘Effects of hydrostatic pressure on matrix synthesis in different regions of the intervertebral disk’, J App Physiol, 1996, 80:839
17 McMillan DW, Garbutt G, Adams MA, ‘Effect of sustained loading on the water content of intervertebral discs. Implications for disc metabolism’, Ann Rheum Dis, 1996, 55:880
18 Urban JP, Roberts S, ‘Degeneration of the intervertebral disc’, Arthritis Res Ther, 2003, 5:120
19 Roughley PJ, ‘Biology of intervertebral disc aging and degeneration. Involvement of the extracellular matrix’, Spine, 2004, 29:2691
20 www.guy-declerck.com / Lumbar intervertebral disc / Nutrition of an inhospitable environment
21 Melrose J, Ghosh P, Taylor TK et al., ‘A longitudinal study of the matrix changes induced in the intervertebral disc by surgical damage to the annulus fibrosus’, J Orthop Res, 1992, 10:665
22 Arun R, Freeman BJ, Scammell BE et al., ‘2009 ISSLS Prize Winner. What influence does sustained mechanical load have on diffusion in the human intervertebral disc? An in vivo study using serial postcontrast magnetic resonance imaging’, Spine, 2009, 34:2324
23 Adams MA, Bogduk N, Burton K, Dolan P (eds), ‘The Biomechanics of Back Pain. 3the Edition’, Edinburgh, Churchill Livingstone, 2013:7
24 Koyama M, Zhang Z, Wang M et al., ‘Bone-like crack resistance in hierarchical metastable nanolaminate steels’, Science, 2017, 355:1055
25 Hampton D, Laros G, McCarron R et al., ‘Healing potential of the anulus fibrosus’, Spine, 1989, 14:398
26 Osti OL, Vernon-Roberts B, Fraser RD, ‘1990 Volvo Award in Experimental Studies. Anulus tears and intervertebral disc degeneration. An experimental study using an animal model’, Spine, 1990, 15:762
27 Kanerva A, Kommonen B, Grönblad M et al., ‘Inflammatory cells in experimental intervertebral disc injury‘, Spine, 1997, 22:2711
28 Rabischong P, Louis P, Vignaud J et al., ‘Le disque intervertébral’, Anat Clin, 1978, 1:55
29 Yoshizawa H, O’Brien JP, Smith WT et al., ‘The neuropathology of intervertebral discs removed for low-back pain’, J Path, 1980, 132:96
30 Coppes MH, Marani E, Thomeer RT, et al., ‘Innervation of "painful" lumbar discs’, Spine, 1997,22:2342
31 Freemont AJ, Peacock TE, Goupille P et al., ‘Nerve ingrowth into diseased intervertebral disc in chronic back pain’, Lancet, 1997, 350:178
32 Brown MF, Hukkanen MV, McCarthy ID et al., ‘Sensory and sympathetic innervation of the vertebral endplate in patients with degenerative disc disease’, J Bone Joint Surg, 1997, 79B:147
33 Peng B, Hao J, Hou S et al., ‘Possible pathogenesis of painful intervertebral disc degeneration’, Spine, 2006, 31:560











Réactions