Douleurs lombaires chez les jeunes patients. Le rôle du noyau et de l’anneau externe jusqu’à 15 ans.
50 % de chances de développer des douleurs lombaires à partir de 15 ans
Avant l’âge de 10-11 ans, on fait rarement état de douleurs lombaires. Une fois à l’adolescence, on remarque une augmentation de ces douleurs1,2,3,4,5. Des recherches sur plus de 400 000 adolescents ont révélé que 11 à 27 % des enfants de 11 ans, 37 % de ceux de 13 ans et près de 50 % de ceux de 15 ans souffrent régulièrement de douleurs dans le bas du dos6,7,8,9,10,11.
Les sacs à dos, souvent énormes, sont pourtant rarement responsables
On pense souvent, à tort, que porter des sacs à dos pleins de livres peut causer des douleurs lombaires chez les élèves. À vrai dire, la recherche auprès des services d’urgence démontre que les sacs à dos sont plutôt utilisés comme moyen d’attaque ou de défense. En effet, cela signifie que les sacs à dos provoquent principalement des blessures au niveau de la tête et du visage (22 %), des mains (12 %), des coudes (12 %), des épaules (12 %), des pieds et des chevilles (12 %). Les blessures au dos ne concernent en réalité que 11 % des cas12,13. Il y a deux explications possibles en cas de douleurs lombaires associées au sac à dos. Soit le sac provoque des contusions au niveau des muscles dorsaux, auquel cas la douleur disparait rapidement, soit il semble entrainer des problèmes dorsaux récurrents, ce qui indique un problème sous-jacent.
Des lésions des disques peuvent-elles apparaitre à un jeune âge ?
Lors d’examens radiologiques des colonnes vertébrales de jeunes adolescents, on remarque souvent les premiers signes d’une dégénérescence discale14. Par autopsie, on observe également un vieillissement prématuré des disques, principalement localisées au niveau de l’anneau fibreux externe (= annulus fibrosus) et des plaques terminales, mais rarement dans le noyau15,16.
Où se trouve le noyau dans un disque jeune et sain ?
Le noyau jeune, sain et intact, appelé nucleus pulposus (NP), est la partie interne, mais pas tout à fait centrale (elle est légèrement décalée vers l’arrière) du disque (Fig. 1). Le noyau représente environ 40 % du disque. Ce petit élément à peu près central est enserré d’un anneau plus large et fibreux (voir plus loin). Au-dessus et sous le noyau se trouvent les plaques terminales cartilagineuses (Fig. 2) (voir article à venir).
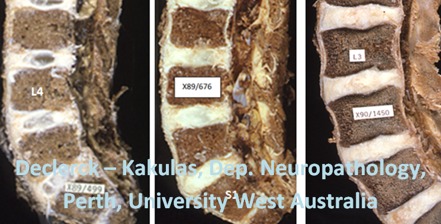
Fig. 1. Les structures blanches sur ces images de coupes sagittales sont les disques intervertébraux à différents âges (gauche : 11 mois, milieu : 9 ans, droite : 22 ans). Ce noyau en forme de rugby, légèrement décalé vers l’arrière, est clairement visible à un jeune âge (gauche et milieu). Le volume des noyaux prend environ 40 % du volume total du disque. Une fois à l’âge adulte (droite), le noyau n’est plus aussi facile à différencier de l’anneau externe. La zone de transition entre les corps vertébraux, les plaques terminales, reste bien visible jusqu’à un âge avancé (voir Fig. 2). (Declerck - Kakulas, Neuropathology Perth, Western Australia, X89/499, X89/676, X89/1450).

Fig. 2. Gauche : Coupe sagittale des disques L4-L5 et L5-S1 chez un homme de 42 ans qui effectuait un travail dur pour le dos en tant que mineur, mais qui n’avait jamais fait état de douleurs dorsales chroniques (Declerck — Kakulas, Neuropathology Perth, Western Australia, X90 — 1420). Ces disques ressemblent encore beaucoup aux disques de jeunes de 15 ans (voir Fig. 1). Cet homme a probablement hérité des gènes qui lui ont assuré des disques résistants. Droite : dessin par le sculpteur, peintre et dessinateur colombien Alonso Ríos (www.alonsoriosescultor.com). Le noyau est représenté en bleu, telle une éponge malléable enserrée d’un anneau fibreux intact (ligné) et séparé des corps intervertébraux par des plaques terminales. À cet âge, une partie des plaques terminales est déjà calcifiée.
Les 15 premières années du noyau discal
Le contenu du noyau est comparable à un pudding semi-liquide, semi-transparent et sans structure (Fig. 1). Jusqu’à l’âge de 15 ans maximum, cette gelée est principalement constituée d’eau (de 70 à 85 % !). La partie restante contient principalement de fines fibres élastiques de collagène (type II), des protéoglycanes et en réalité assez peu de cellules (environ 4 000 000/cm3)17. Au début se trouvent également dans ce noyau des cellules embryonnaires qui ralentissent le vieillissement et la dégénérescence. À l’âge de 15 ans cependant, la nature a éliminé ces cellules notochordales. Et c’est bien dommage. Elles produisent la grande majorité des protéoglycanes qui permettent d’absorber et maintenir l’eau18,19,20,21. Pour pouvoir fonctionner correctement d’un point de vue mécanique, une grande quantité d’eau doit rester présente dans le noyau.
Le jeune noyau ressemble à une éponge pleine d’eau
Étant donné que le noyau se compose de fines fibres de collagène élastiques et l’eau n’est pas compressible, il adapte en permanence sa forme au long des diverses activités de la journée. Aussi longtemps que le noyau contient assez d’eau, il est tout à fait capable de résister aux continuelles variations de pression (= pression hydrostatique). Les plaques terminales et la partie interne de l’anneau fibreux se composant principalement des fibres de collagène élastiques, les trois parties du disque sont fortement rattachées les unes aux autres22,23 et forment un ensemble mécanique. Passé l’âge de 15 ans, le mécanisme n’est plus aussi bien huilé, et des lésions apparaissent dans l’anneau externe et/ou les plaques terminales.
Le processus de vieillissement du disque commence à 15 ans
À 15 ans, plus aucune cellule notochordale permettant de ralentir le vieillissement n’est présente dans le disque. Il ne peut plus y avoir autant d’eau retenue, ce qui entraîne un dysfonctionnement des fonctions mécaniques du noyau. Les autres cellules ne sont pas en état d’amortir la baisse de production de protéoglycanes et commencent à produire des fibres de collagène beaucoup plus coriaces (type I). Depuis l’âge de 15 ans, et pendant la décennie suivante, la substance du noyau s’altère et passe d’un gel aqueux gonflé de protéoglycanes à une structure asséchée de cartilage et de tissus cicatriciels16,24. Étant donné que la perte d’eau est le signe biologique typique d’un processus de vieillissement, le disque est le premier organe du corps à vieillir, et à un jeune âge. Néanmoins, le vieillissement du disque n’est généralement pas lié à des douleurs.
Le jeune noyau serait la source des douleurs lombaires
Aussi longtemps que le noyau contient suffisamment de protéoglycanes, il est capable de réguler lui-même sa concentration en eau grâce à son rythme jour-nuit (voir article « Le rythme jour-nuit du disque intervertébral »), maintenir la qualité de son cartilage (voir article « Le mystère du cartilage discal ») et sa fonction mécanique de façon optimale. Un jeune noyau sain ne contient pas de vaisseaux sanguins ou de nerfs, car sa pression hydrostatique interne est plus importante que la pression sanguine environnante. Les vaisseaux sanguins qui malgré tout auraient pu pénétrer dans le disque se retrouvent écrasés par la pression25. Le jeune disque peut se déchirer lors d’un accident, ou bien des processus dégénératifs prématurés comment à se déclarer dans les disques, ce qui mène ultérieurement à une perte d’eau et une pression hydrostatique réduite. Lors des processus de guérison, des petits vaisseaux sanguins et des nerfs pénètrent dans le noyau26, amenant souvent des douleurs lombaires.
De quoi se compose l’anneau externe du disque ?
L’anneau fibreux est la structure la plus résistante du corps, et constitue la gaine de fibres qui enserre le noyau (Fig. 1, 2 et 3). Il ne contient que 50 % d’eau, mais il s’y trouve bien plus de cellules (9 000 000/cm3) que dans le noyau. Cela indique un métabolisme plus actif. Afin de pouvoir remplir ses fonctions, l’anneau a également besoin de plus d’énergie mécanique. Les 50 % restants sont des protéines. Une petite partie de celles-ci (10 %) sont constituées de protéoglycanes. La majeure partie se compose de 70 % de collagène coriace (type I) et 20 % de collagène flexible (type II).
L’épaisse partie externe de l’anneau est la plus importante
De buitenste drie vierden (Fig. 3) zijn hoofdzakelijk opgebouwd uit de sterkere en minder rekbare collageenvezels die vastgeankerd zitten in het been van de wervellichamen27,28,29. Qua taaiheid kan men ze vergelijken met de glasvezels die gebruikt worden om remblokken en ski’s te versterken. Ze functioneren dus als sterke ligamenten30. Ze verhinderen dat wervels buitensporig t. o. v. elkaar kunnen buigen en draaien, en verklaren waarom wij slechts in beperkte mate rondom onze lichaamsas kunnen draaien31,32,33,34.
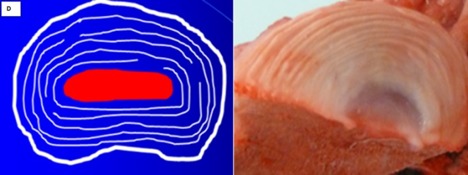
Fig. 3. Gauche : Représentation schématique de l’architecture d’un anneau fibreux enserrant le noyau (rouge). L’anneau de fibres a une structure particulière. Il se constitue de 15 à 25 couches de lamelles, composées principalement de fibres de collagène malléable de type 2. La structure circulaire ou cylindrique affiche de nombreuses anormalités et ruptures. Si la construction était réellement parfaite, il n’y aurait probablement pas de hernie possible. Droite (remerciements aux services de soins animaliers de Flandre) : Section du disque d’un porc (sus scrofa domesticus). Le noyau gris-bleu est directement entouré de fibres de collagène de type 2, plus fines et flexibles (= la partie blanche). À mesure que l’on s’éloigne du noyau, le collagène de type 2 est remplacé par du collagène de type 1, dont les lamelles sont clairement visibles.
La structure de l’anneau ressemble à un livre debout
L’anneau peut être comparé à un fin livre de 15 à 25 pages, qui serait mis debout sur sa tranche comme un cylindre. Dans l’anneau, chaque couche est appelée une lamelle. Il s’agit d’une fine couche de fibres coriaces de collagène27. Chaque lamelle est reliée par de fines fibres de collagène élastique aux autres35. Cela leur permet de glisser l’une sur l’autre36,37,38. Comme vous le savez probablement, il faut une force énorme pour écraser un livre dans cette position, tout comme il en faut aussi énormément pour détacher les fins liens élastiques entre les lamelles, et donc écraser l’anneau et le faire rompre31,32,36,39,40,41.
L’anneau solide et coriace est comparable à des dalles de béton
L’anneau se compose de fibres (Fig. 3 et 4). Comparable à un mur de briques, l’anneau, s’il n’est pas « cimenté », peut ne pas supporter la charge. Ici, ce sont les fibres de collagène de type 1 qui consolident sa structure. Si l’anneau n’était composé que d’eau, cellules, protéoglycanes et de collagène de type 2 (flexible), il s’effondrerait sur lui-même à la moindre charge verticale. La nature renforce donc l’anneau à l’aide de collagène plus coriace, mais tout comme dans le noyau, les processus de vieillissement réduisent progressivement le nombre et la solidité des lamelles.
La robustesse de l’anneau, comparable à une clôture de jardin
La robustesse de cet anneau est comparable à la structure d’une palissade, constituée d’une vingtaine de clôtures serrées les unes contre les autres, et dont chaque grillage s’entrecroise. La robustesse de l’anneau est renforcée par le fait que les fibres de collagènes des lamelles adjacentes s’orientent dans des directions différentes (Fig. 4). Essayez donc de découper 15 ou 25 couches d’une telle clôture !
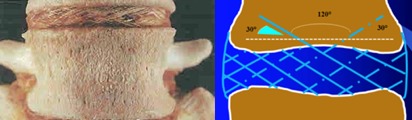
Fig. 4. Gauche : illustration informative (Service de Pathologies neuromusculaires de Perth, Australie). Dans chacune des 15 à 25 lamelles qui forment une couche de l’anneau cylindrique, le sens des fibres coriaces de collagène de type 1 s’alterne. Grâce à structure spéciale unique, l’anneau est capable de résister à des forces verticales. Ces fibres de collagène de type 1 sont aussi résistantes que les fibres de verre des plaquettes de frein. Même en vieillissant, ils restent capables de résister aux forces qui s’exercent sur eux42.
Un jeune anneau peut aussi former des bombements discaux
Aussi longtemps que les fibres de collagène coriaces externes restent intactes, un jeune anneau ne fera que rarement l’objet de bombements discaux. Lorsque l’anneau finit par lâcher à cause de la multiplication des déchirures et des bombements peuvent apparaitre. C’est comparable à un pneu de vélo qui a une fuite. La pression du pneu diminue jusqu’à ce qu’il devenir plat34,43. Aussi longtemps que les fibres coriaces de collagène sont intactes et reliées par du collagène malléable, les déchirures de l’anneau lors de mouvements de torsion sont très peu probables. Cela nécessite donc beaucoup d’énergie de provoquer de grandes déchirures de l’anneau31,32,41.
La partie interne de l’anneau est élastique et moins résistante
La partie interne, plus fine, contient de nombreuses fines fibres de collagène moins résistantes et plus élastiques27,28. Elles sont moins coriaces31, mais aussi fixées aux plaques terminales22,23. Cette partie ne joue qu’un rôle limité dans le contrôle des mouvements du bas du dos. La fonction principale est d’empêcher l’apparition de déchirures dans l’anneau35. Si ces fibres, suite à un accident ou en raison de processus de dégénérescence, en viennent à se déchirer, des petites cicatrices locales apparaissent et restent généralement limitées. On peut les comparer à des trous dans des bas en nylon. Étant donné que la partie externe de l’anneau abrite quelques vaisseaux sanguins et nerfs, les déchirures sont à même de provoquer des douleurs lombaires.
De nombreuses impuretés et anomalies dans l’anneau
Lors d’analyses de disques lombaires en laboratoire, on a remarqué de nombreuses anomalies dans la structure lamellaire. Au niveau de l’arrière de l’anneau fibreux, il y a beaucoup moins de fibres de collagène de type 1. Les lamelles y sont aussi moins solidement attachées par le collagène de type 2, ce qui peut facilement provoquer d’autres fissures. Cette situation est comparable à un tronc vieillissant (Fig. 5). C’est la raison pour laquelle on remarque par IRM que la majorité des bombements se situent sur la partie postérieure de la colonne. C’est de ce côté que la plupart des hernies se déclarent27,28.

Fig. 5. Dans cette coupe transversale d’un vieux tronc d’arbre asséché, on peut apercevoir des ruptures aussi bien radiale que concentrique. Tout comme l’anneau humain, ces fissures s’orientent dans trois dimensions. Néanmoins, vu que les radios, les CAT-scans et les IRM ne peuvent représenter qu’en deux dimensions, il est difficile de comprendre clairement comment l’apparition, le développement et l’évolution de telles fissures. C’est pourquoi de nombreuses déchirures ne sont même pas détectées44. Une autopsie révèle beaucoup plus de ces fissures — suspectées d’être à l’origine des douleurs lombaires — qu’une IRM45,46.
L’article suivant s’attardera sur les plaques terminales cartilagineuses comme responsable habituelles de douleurs dans le bas du dos.
Références
1 Paajanen H, Erkintalo M, Kuusela T et al., ‘Magnetic resonance study of disc degeneration in young low-back pain patients’, Spine, 1989, 14:982
2 Gunzburg R, Parkinson R, Moore R et al., ‘A cadaveric study comparing discography, magnetic resonance imaging, histology, and mechanical behavior of the human lumbar disc’, Spine, 1992, 17:417
3 Videman T, Nummi P, Battié MC et al., ‘Digital assessment of MRI for lumbar disc desiccation. A comparison of digital versus subjective assessments and digital intensity profiles versus discogram and macroanatomic findings’, Spine, 1994, 19:192
4 Watson KD, Papageorgiou AC, Jones GT et al., ‘Low back pain in schoolchildren. Occurrence and characteristics’, Pain, 2002, 97:87
5 Balagué F, Dudler J, Nordin M, ‘Low-back pain in children’, Lancet, 2003, 361:1403
6 Burton AK, Clarke RD, McClune TD et al., ‘The natural history of low back pain in adolescents’, Spine, 1996,21:2323
7 Jones GT, Macfarlane GJ, ‘Epidemiology of low back pain in children and adolescents’, Arch Dis Child, 2005, 90:312
8 Hestbaek L, Leboeuf-Yde C, Kyvik KO, ‘Is comorbidity in adolescence a predictor for adult low back pain? A prospective study of a young population’, BMC Musculoskeletal Disord, 2006, 7:29
9 Hoy D, Bain C, Williams G et al., ‘A systematic review of the global prevalence of low back pain’, Arthritis Rheum, 2012, 64:2028
10 Calvo-Munoz I, Gomez-Conesa A, Sanchez-Meca, ‘Prevalence of low back pain in children and adolescents. A meta-analysis’, BMC Pediatrics, 2013, 13:14
11 Swain MS, Henschke N, Kamper SJ et al., ‘An international survey of pain in adolescents’, BMC Public Health, 2014, 14:447
12 Wiersema BM, Wall EJ, Foad SL, ‘Acute backpack injuries in children’, Pediatrics, 2003, 111:163
13 Cardon G, Balagué F, ‘Low back pain prevention's effects in schoolchildren. What is the evidence?,’ Eur Spine J, 2004, 13:663
14 Kjaer P, Leboeuf-Yde C, Sorensen JS et al., ‘An epidemiologic study of MRI and low back pain in 13-year-old children’, Spine, 2005, 30:798
15 Boos N, Weissbach S, Rohrbach H et al., 'Classification of age-related changes in lumbar intervertebral discs. 2002 Volvo Award in basic science’, Spine, 2002, 27:2631
16 Haefeli M, Kalberer F, Saegesser D et al., ‘The course of macroscopic degeneration in the human lumbar intervertebral disc’, Spine, 2006, 31:1522
17 Declerck GMC, ‘www.guy-declerck.com / Lumbar intervertebral disc / Intradiscal cells’
18 Trout JJ, Buckwalter JA, Moore KC et al., ‘Ultrastructure of the human intervertebral disc. I. Changes in notochordal cells with age’, Tissue Cell, 1982, 14:359
19 Kim KW, Lim TH, Kim JG et al., ‘The origin of chondrocytes in the nucleus pulposus and histologic findings associated with the transition of a notochordal nucleus pulposus to a fibrocartilaginous nucleus pulposus in intact rabbit intervertebral discs’, Spine, 2003, 28:982
20 Guehring T, Wilde G, Sumner M et al., ‘Notochordal intervertebral disc cells. Sensitivity to nutrient deprivation’, Arthritis Rheum, 2009, 60:1026
21 Risbud MV, Shapiro IM, ‘Notochordal cells in the adult intervertebral disc. New perspective on an old question’, Crit Rev Eukaryot Gene Expr, 2011, 21:29
22 Peacock A, ‘Observations on the prenatal development of the intervertebral disc in man’, J Anat, 1951, 85:260
23 Taylor JR, ‘The development and adult structure of lumbar intervertebral discs’, J Man Med, 1990, 5:43
24 Antoniou J, Steffen T, F Nelson et al., ‘The human lumbar intervertebral disc. Evidence for changes in the biosynthesis and denaturation of the extracellular matrix with growth, maturation, ageing, and degeneration’, J Clin Invest, 1996, 98:996
25 Adams MA, Bogduk N, Burton K, Dolan P (eds), ‘The Biomechanics of Back Pain. 3the Edition’, Churchill Livingstone, Edinburgh, 2013:204
26 Kauppila LI, ‘Ingrowth of blood vessels in disc degeneration. Angiographic and histological studies of cadaveric spines’, J Bone Jt Surg, 1995, 77A:26
27 Marchand F, Ahmed AM, ‘Investigation of the laminate structure of lumbar disc anulus fibrosus’, Spine, 1990, 15:402
28 Skaggs DL, Weidenbaum M, Iatridis JC et al., ‘Regional variation in tensile properties and biochemical composition of the human lumbar anulus fibrosus’, Spine, 1994, 19:1310
29 Skrzypiec D, Tarala M, Pollintine P et al., ‘When are intervertebral discs stronger than their adjacent vertebrae?’, Spine, 2007, 32:2455
30 Johnson EF, Chetty K, Moore IM et al., ‘The distribution and arrangement of elastic fibres in the intervertebral disc of the adult human’, J Anat, 1982, 135:301
31 Green TP, Adams MA, Dolan P, ‘Tensile properties of the annulus fibrosus II. Ultimate tensile strength and fatigue life’, Eur Spine J, 1993, 2:209
32 Adams MA, Green TP, Dolan P, ‘The strength in anterior bending of lumbar intervertebral discs’, Spine, 1994, 19:2197
33 Markolf KL, Morris JM, ‘The structural components of the intervertebral disc. A study of their contributions to the ability of the disc to withstand compressive forces’, J Bone Jt Surg, 1974, 56A:675
34 Brinckmann P, Grootenboer H, ‘Change of disc height, radial disc bulge, and intradiscal pressure from discectomy. An in vitro investigation on human lumbar discs’, Spine, 1991, 16:641
35 Schollum ML, Robertson PA, Broom ND, ‘ISSLS prize winner. Microstructure and mechanical disruption of the lumbar disc annulus. Part I. A microscopic investigation of the translamellar bridging network’, Spine, 2008, 33:2702
36 Fujita Y, Duncan NA, Lotz JC, ‘Radial tensile properties of the lumbar annulus fibrosus are site and degeneration dependent’, J Orthop Res, 1997, 15:814
37 Yu J, Tirlapur U, Fairbank J et al., ‘Microfibrils, elastin fibres and collagen fibres in the human intervertebral disc and bovine tail disc’, J Anat, 2007, 210:460
38 Shine KM, Simson JA, Spector M, ‘Lubricin distribution in the human intervertebral disc’, J Bone Joint Surg, 2009, 91A:2205
39 Keyes DC, Compere El, ‘The normal and pathological physiology of the nucleus pulposus of the intervertebral disc. An anatomical, clinical e-and experimental study’, J Bone Joint Surg, 1932, 14A:897
40 Ritchie JH, Fahrni WH, ‘Age changes in lumbar intervertebral discs’, Can J Surg, 1970, 13:65
41 Adams MA, Green TP, ‘Tensile properties of the annulus fibrosus. I. The contribution of fibre-matrix interactions to tensile stiffness and strength’, Eur Spine J, 1993, 2:203
42 Ebara S, Iatridis JC, Setton LA et al., ‘Tensile properties of nondegenerate human lumbar anulus fibrosus’, Spine, 1996, 21:452
43 Adams MA, McNally DS, Dolan P, ‘'Stress' distributions inside intervertebral discs. The effects of age and degeneration’, J Bone Joint Surg, 1996, 78B:965
44 Videman T, Nurminen M, ‘The occurrence of anular tears and their relation to lifetime back pain history. A cadaveric study using barium sulfate discography’, Spine, 2004, 29:2668
45 Osti OL, Fraser RD, ‘MRI and discography of annular tears and intervertebral disc degeneration. A prospective clinical comparison’, J Bone Joint Surg, 1992, 74B:431
46 Kakitsubata Y, Theodorou DJ, Theodorou SJ et al., ‘Magnetic resonance discography in cadavers. Tears of the annulus fibrosus’, Clin Orthop Relat Res, 2003, 407:228











Réactions