Het lot van uw verouderende discus wanneer het degeneratieproces intreedt
Zien hoe je huis instort, is pijnlijk. Dit is het lot van uw verouderende discus wanneer het degeneratieproces intreedt.
De meesten onder ons zullen niet probleemloos oud worden
De meeste mensen zijn niet gemaakt om probleemloos oud te worden. In onze chromosomen is geen DNA voorhanden die in staat is verouderingsprocessen tegen te houden. De veroudering gaat onverstoord haar gang en zorgt voor een hele reeks gekende aandoeningen die ons, sneller dan nodig, doen verslijten. Veel te vroeg krijgen we last van artrose, problemen met onze bloedvaten, dementie, diabetes, doofheid, hartziekten, hemorroïden, kanker, longaandoeningen, osteoporose, en niet in het minst lage rugpijn (1). Nog een 300-tal andere weinig begrepen medische aandoeningen kunnen velen onder ons de duivel aandoen(2).
Onze verouderende organen lijken niet meer op wat ze waren
Verouderen is een dynamisch proces. Dit is een natuurlijk gegeven waardoor de activiteit van onze verouderende organen steeds minder gaat lijken op die van vroeger toen ze nog jong waren en perfect functioneerden. Het aantal ziektes neemt toe. In rusthuizen wordt de medische machteloosheid tegenover deze multimorbiditeit (3) duidelijk vastgesteld. Slechts de farma-industrie vaart er wel bij. Massa’s medicatie stellen de finale instorting van de menselijke natuur nog een tijdje uit, maar van genezen is geen sprake meer. Medicijnen kunnen in geen geval de klok terugdraaien. Toch merken we af en toe hoe 90-jarigen beschikken over genencombinaties die hen beschermen tegen de eigen biologische destructieve mechanismen en schadelijke omgevingsfactoren (4, 5, 6, 7, 8). Deze uitzonderingen zijn dan ook in staat langere tijd normaal fysisch en mentaal te functioneren.
Spijtig dat onze discussen zo vroeg moeten verslijten
Omdat de natuur om een of andere reden beslist heeft haar beschermende notochordale cellen uit de discussen te verwijderen, zal, in tegenstelling tot de meeste dieren, iedere discus in de menselijke wervelzuil reeds op jeugdige leeftijd verouderen (cf. Blog ‘Discusbulgings zijn doorgaans slechts een ouderdomsverschijnsel’). Mocht een wetenschapper ooit ontdekken waarom deze cellen zo vroeg verdwijnen, dan is het niet uitgesloten dat voor ‘eenvoudige’ en zogenaamde ‘aspecifieke lage rugpijn’ (9, 10) - en dus nog niet-begrepen lage rugpijn - eindelijk eens een efficiënte gepersonaliseerde behandeling zou kunnen ontwikkeld worden (cf. Blog ‘Zoektocht naar een gepersonaliseerde therapie voor lage rugpijn’). Voorlopig moeten we het nog steeds stellen met medicijnen, spuitjes, oefeningen, kinesitherapeutische en chirurgische behandelingen, waarbij men nog steeds de illusie koestert dat deze remedies bij iedereen wereldwijd hetzelfde - goede of slechte - resultaat zullen afwerpen. Geen enkele techniek is evenwel in staat verouderings- en slijtageprocessen tegen te gaan, een verouderende discus te herstellen of de slijtage ervan uit te stellen.
Hebt u geen beschermende discusgenen, dan is het bingo!
Meer dan de helft van de wereldbevolking erft geen beschermende discusgenen (11, 12) en ontwikkelt daarom tijdens de groeifase onvoldoende sterke discussen. Deze snel verouderende discussen zijn dan slechts gedurende een korte levensfase in staat om probleemloos weerstand te bieden tegen de immense fysische krachten die dagelijks tijdens het zitten, staan, stappen, werken en sporten op hen inwerken. De discus is doorgaans ook het eerste orgaan dat zal verslijten. Het is daarom ook het eerste orgaan waarin tijdens lijkschouwingen op eender welke leeftijd degeneratieve letsels kunnen aangetoond worden (13, 14, 15, 16, 17, 18, 19, 20).
Wat moet men verstaan onder ‘discusdegeneratie’?
De biologische structuur van de drie discusonderdelen wordt gewijzigd omdat er tijdens het verouderingsproces in de discuskernen bijzonder veel onomkeerbare moleculaire veranderingen optreden (17, 20, 21, 22, 23). Deze mutaties verstoren ook de normale mechanische discusfuncties. In wezen komt het hierop neer dat degenererende discussen op elk ogenblik van ons leven het product zijn van de kwantiteit en de kwaliteit van hun biologische afbraakprocessen en hun gelijktijdige pogingen tot herstel (Schema 1).
- Steeds minder cellen
- Steeds minder bloedvoorziening
- Steeds minder voeding
- Steeds minder suikereiwitten (= proteoglycanen)
- Steeds minder water
- Steeds minder elastische collagene eiwitten (type 2)
- Steeds minder goed functionerende cellen
- Steeds meer snel verouderende cellen
- Steeds meer taaie collagene eiwitten (type 1)
- Steeds meer vernietigende enzymen
- Steeds meer afbraakproducten
Schema 1. Samenvatting van de biologische afbraakprocessen die in de discuskern optreden vanaf het moment dat hij begint te verouderen. Doorgaans leiden deze biologische veranderingen tot het uiteindelijke functionele falen van de discus. Er bestaat voorlopig geen enkele methode om deze evolutie rechtstreeks vast te stellen. De afwijkingen leiden in de regel tot de vernietiging van de discus.
Herstel is slechts mogelijk via littekenvorming, wat de oorspronkelijke structuur verstoort
Discussen kunnen niet genezen en daarom gebeurt hun herstel uitsluitend via vorming van littekenweefsel. Om deze reden blijft hun structuur niet intact. Ze moeten continu hun tactiek aanpassen om weerstand te kunnen bieden aan de dagelijkse inwerkende krachten. Uiteindelijk worden ze mechanisch ‘moe’. Door de opstapeling van vermoeidheidsletsels kan de slijtageslag beginnen. En hoewel de genetische invloed op alle discussen gelijk is, toch is de snelheid waarmee het degeneratieproces voortschrijdt voor elke discus verschillend (cf. volgende blog). Niet iedere discus biedt op hetzelfde ogenblik dezelfde weerstand tegen de dagelijks inwerkende krachten. De structuur van de ene zal sneller onder de druk bezwijken dan die van de andere (Fig. 1)
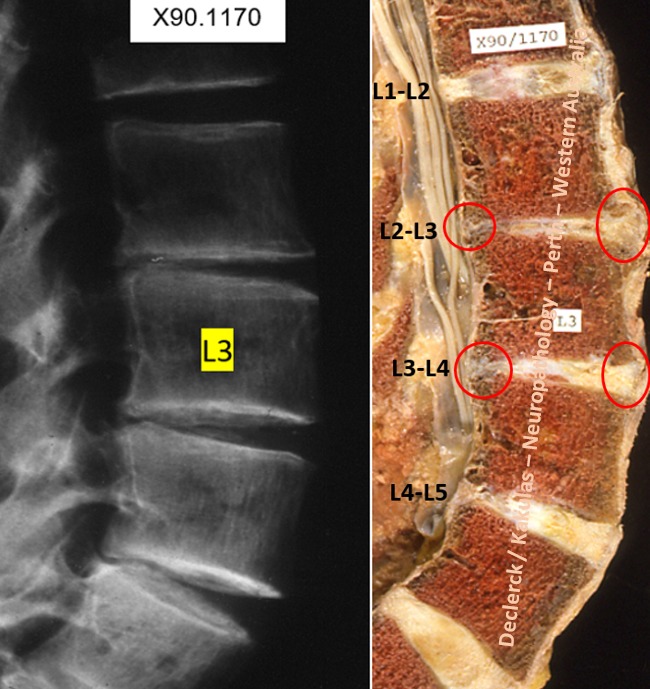
Fig. 1. X90-1170. Declerck / Kakulas, Neuropathology, Perth, Western Australia.
Enerzijds als gevolg van de voortschrijdende afbraak van suikereiwitten en het hiermee gepaard gaand verlies van de waterinhoud (24), anderzijds door de vervanging van oorspronkelijke fijne (type 2) eiwitten door veel sterkere collagene eiwitten (type 1) (25a), verandert vanaf de leeftijd van 20 jaar de discuskern vrij snel qua samenstelling, uitzicht en functie. Omdat de buitenste vezelring eveneens hoofdzakelijk opgebouwd is uit dezelfde collagene vezels (type 1), ontstaat er niet alleen een zichtbare continuïteit in de structuur van de kern zelf, maar vervaagt ook geleidelijk aan de grens tussen kern en vezelring (hier L5-S1 op afbeelding) (14, 25b). De kernen ‘drogen uit’, lijken steeds meer op littekenweefsel en worden brozer. De witte kleur van de discus verandert in een bruingele kleur die typisch is voor het verouderingsproces (in dit voorbeeld iedere discus) (26, 27, 28). Dit is te wijten aan de opstapeling van het verouderingspigment lipofuscine (29, 30). Het volledige verouderingsproces kan men vergelijken met het oxiderende roestproces van ijzer (27). Echter, door dehydratatie zijn de discuskernen ook niet langer meer in staat de dagelijkse lasten op een eenvormige manier van wervellichaam tot wervellichaam door te geven. In de ontwrichte discus ontstaan verschillende zones die op lukrake manier weerstand bieden aan de inwerkende compressiekrachten (31, 32). Omdat de verdeling van de ondergane lasten dan ook niet meer gelijkmatig gebeurt in het kraakbeenweefsel van de kern, kunnen hier scheuren optreden (hier L2-3 en L3-L4). Een steeds groter deel van de compressieve lasten wordt door de vezelring overgenomen. Er ontstaan annulaire bulgings (rode cirkels L2-L3 en L3-4). Vermindering van de discushoogte is het typische bewijs van degeneratieprocessen (hier L1-L2, L2-L3, L3-L4, L4-L5) (33, 34, 35).
Hoe evolueert de verstoring van de structuur van de discuskern tot stapsgewijze mechanische verstoring van annulus en eindplaten?
Door de toename van de verschillende biologische verouderingstekenen (Schema 1) verandert de geleiachtige structuur van de discuskernen in harder littekenweefsel (Fig. 1). Dit geeft aanleiding tot beginnende slijtage, waardoor de mechanische functie van de drie discusonderdelen kan verstoord worden (cf. Blog ‘Verouderen blijft niet zonder gevolgen. Discuscellen moeten snel hun strategie aanpassen’).
A. Vooreerst is de kern steeds minder in staat de inwerkende krachten op te vangen, waardoor onomkeerbare annulaire bulgings ontstaan die alleen maar in volume kunnen toenemen (36, 37).
B. Tijdens het verouderingsproces geraken de eindplaten en annulus onder de toenemende mechanische spanning ook steeds meer vermoeid. Net zoals vermoeiingsscheuren zich doorheen technische materialen kunnen uitbreiden (38), zullen vermoeidheidsletseltjes (39, 40), die eerst in de kern optreden, zich doorheen de eindplaten en annulus uitbreiden (Fig. 2) (cf. ook volgende blog). Vanaf de leeftijd van 20 jaar stapelen zich in de drie discusstructuren honderden schadelijke vermoeidheidsletseltjes op (15, 19, 41, 42, 43). Omdat het resterende water uit de kern doorheen de ontstane letseltjes geperst wordt, nemen de scheurtjes in breedte toe (44). In al die letseltjes verschijnen trouwens ook ontstekingscellen die de scheuren nog vergroten (38, 45) (cf. volgende blogs).
C. Tenslotte krijgen de overblijvende cellen, die vermoedelijk almaar meer ‘overuren’ moeten presteren om de herstellingswerken te helpen uitvoeren, er ook genoeg van. Ze gaan vervroegd met pensioen (= apoptose), verouderen nog sneller (= senescentie) en sterven vroeger af (= necrose) (46). Zelfs de pas overleden cellen zullen zich in groepjes verzamelen (= clusters) en uiteindelijk ook hun werk neerleggen (47, 48, 49). De mechanische functie van de discus wordt definitief ontregeld (50, 51).

Fig. 2. Declerck / Kakulas, Neuropathology, Perth, Western Australia X90-1063 / X89-859 / X89-1133.
Wanneer de verouderende discussen hun hoogte verliezen, wijst dit erop dat het slijtageproces onomkeerbaar ingetreden is. Omdat deze discussen hun elasticiteit verloren hebben en veel stijver geworden zijn, zullen ze in toenemende mate bezwijken onder de dagelijkse lasten. In de discuskernen verschijnen steeds meer barsten en scheurtjes (52, 53). Discussen beschikken over geen enkele mogelijkheid zich in hun oorspronkelijke staat te herstellen. Integendeel, de opgetreden scheurtjes geven zelf aanleiding tot verdere afbraak van de resterende suikereiwitten en collageenvezels type 2 (54). In al die letseltjes verschijnen trouwens ook ontstekingscellen die de scheuren nog vergroten (38, 45). Dit dramatisch structureel uiteenscheuren van de discuskern treedt in toenemende mate op vanaf middelbare leeftijd. Ze worden veel minder vastgesteld ter hoogte van de bovenste L1-2, L2-L3 en L3-L4 discussen (hier afgebeeld) dan t. h. v. de twee onderste L4-L5 en L5-S1 discussen (55, 56). De scheurtjes breiden zich geleidelijk aan uit doorheen de nochtans dikker geworden lamellen van de annulus (17, 27, 57, 58). Deze interne discogene disruptie leidt tot een stapsgewijze mechanische verstoring van de volledige discus. Naarmate de discusdegeneratie verder evolueert, zullen we onze lage rug moeilijker voorover, achterover of zijdelings kunnen bewegen, terwijl de draaibeweging makkelijker kan verlopen (59, 60, 61, 62, 63)
De mechanische verstoring leidt tot ineenstorting van de discus
Toenemende degeneratie resulteert in de vorming van steeds meer kloofjes, scheuren en breuken in de drie discusonderdelen (64, 65, 66, 67, 68). De dramatische, vooruitschrijdende en onherstelbare structurele slijtageslag zal ertoe leiden dat de discuskernen desintegreren en fragmenteren. Vanaf de leeftijd van 40 jaar en vooral ter hoogte van de twee onderste L4-L5 en L5-S1 discussen (55, 56), kan men degenererende discuskernen in toenemende mate vergelijken met scheuren in de muren van een nieuwbouw, een instortend huis of vele stukjes ‘krabvlees’ (Fig. 3). Discusbulgings blijven uiteraard bestaan of nemen zelfs toe (69). Het wordt opletten geblazen wanneer deze bulgings verkeerdelijk als discushernia’s geïnterpreteerd worden. Wie in de val loopt door ze te laten wegnemen, gaat een levenslange rugmiserie tegemoet (cf. latere blogs).
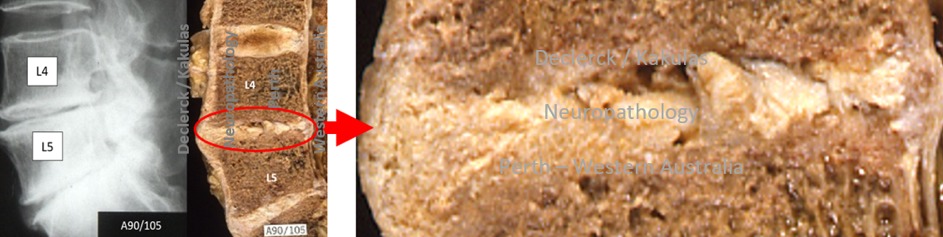
Fig. 3. Declerck / Kakulas, Neuropathology, Perth, Western Australia A90-105.
Wanneer de structuur zeer ernstig gedegenereerd is (hier rode cirkel rond L4-L5), vallen de discussen als kaarthuisjes in elkaar (50). Natuurlijk herstel is onmogelijk. De discuskernen verbrokkelen. Meerdere losliggende bindweefselachtige klontertjes liggen los tussen het resterende ‘gezonde’ discusweefsel. De kernen lijken zeer goed op krabvlees (70). De mechanische functie van deze discussen is volledig ontregeld. Ter hoogte van de L3-L4 discus bemerkt men de typische bruingele verkleuring, te vergelijken met roestend ijzer.
In volgende blogs wordt verder aangetoond waarom courante radiologische en digitale beelden geen details opleveren die toelaten ‘eenvoudige en aspecifieke’ lage rugpijn te verklaren. Dit in tegenstelling tot wat routinegewijs vastgesteld werd tijdens de ontleding van 23.539 menselijke wervelzuilen (dus ongeveer 142.000 discussen) tussen de 12de borstwervel en 1ste sacrale wervel.
Referenties
1. Olshansky SJ, Carnes BA, Butler RN, ‘If humans were build to last, we would look a lot different if evolution had designed the human body to function smoothly for a century or more’,
Scientific American, 2015, 24:107
2. GBD 2016 Disease and Injury Incidence and Prevalence Collaborators, ‘Global, regional, and national incidence, prevalence, and years lived with disability for 328 diseases and injuries for 195 countries, 1990-2016. A systematic analysis for the Global Burden of Disease Study 2016’,
Lancet, 2017, 390:1211
3. Chatterji S, Byles J, Cutler D et al., ’Health, functioning, and disability in older adults. Present status and future implications’,
Lancet, 2015, 385:563
4. Sinclair DA en Guarente L, ‘Unlocking the secrets of longevity genes’,
Scientific American, March 2006:30
5. Perls TT, ‘The oldest old. People in their late 90s or older are often healthier and more robust than those 20 years younger. Traditional views of aging may need rethinking’,
Scientific American, 2015, 24:100
6. van den berg N, Beekman M, Smith KR et al., ‘Historical demography and longevity genetics. Back to the future’,
Ageing Res rev, 2017, 38:28
7. Slagboom PE, van den Berg N, Deelen J, ‘Phenome and genome based studies into human ageing and longevity. An overview’,
Biochim Biophys Acta, 2018, 1864:2742
8. Kaplanis J, Gordon A, Short T et al., ‘Quantitative analysis of population-scale family trees with millions of relatives’,
Science, 2018, 360:171
9. Hartvigsen J, Hancock MJ, Kongsted A et al., 'What low back pain is and why we need to pay attention’,
Lancet, 2018, doi.10.1016/S0140-6736(18)30480-X
10. Foster NE, Anema JR, Cherkin D et al., ‘Prevention and treatment of low back pain. Evidence, challenges, and promising directions’,
Lancet, 2108, doi.10.1016/S0140-6736(18)30489-6
11. Hartvigsen J, Nielsen J, Kyvik KO et al., ‘Heritability of spinal pain and consequences of spinal pain. A comprehensive genetic epidemiologic analysis using a population-based sample of 15,328 twins ages 20–71 years’,
Arthritis Rheum, 2009, 61:1343
12. Ferreira PH, Beckenkamp P, Maher CG et al., ‘Nature or nurture in low back pain? Results of a systematic review of studies based on twin samples’,
Eur J Pain, 2013, 17:957
13. Heine J, ‘Uber die Arthritis deformans‘,
Virchows Arch Pathol Anat, 1926, 260:521
14. Coventry MB, Ghormley RK, Kernohan JW, ‘The intervertebral disc. Its microscopic anatomy and pathology. Part I. Anatomy, development, and physiology’,
J Bone Joint Surg, 1945, 27A:105
15. Miller JA, Schmatz C, Schultz AB, ‘Lumbar disc degeneration. Correlation with age, sex, and spine level in 600 autopsy specimens’,
Spine, 1988, 13:173
16. Andersson GBJ, ‘The epidemiology of spinal disorders’,
In: Frymoyer JW (Editor), ‘The Adult Spine. Principles and Practice’,
Raven Press, 1991:107
17. Boos N, Weissbach S, Rohrbach H et al., ‘2002 Volvo Award in basic science. Classification of age-related changes in lumbar intervertebral discs’,
Spine, 2002, 27:2631
18. Gruber HE, Hanley EN Jr, ‘Analysis of aging and degeneration of the human intervertebral disc. Comparison of surgical specimens with normal controls’,
Spine, 1998, 23:751
19. Battié MC, Videman T, Parent E, ‘Lumbar disc degeneration. Epidemiology and genetic influences’,
Spine, 2004, 29:2679
20. Freemont AJ, Hoyland JA, ‘Morphology, mechanisms and pathology of musculoskeletal ageing’,
J Pathol, 2007, 211:252
21. Guiot BH, Fessler RG, ‘Molecular biology of degenerative disc disease’,
Neurosurgery, 2000, 47:1034
22. Tanaka N, An HS, Lim TH et al., ‘The relationship between disc degeneration and flexibility of the lumbar spine’,
Spine J, 2001, 1:47
23. Singh K, Masuda K, Thonar EJMA et al., ‘Age-related changes in the extracellular matrix of nucleus pulposus and anulus fibrosus of human intervertebral disc’,
Spine, 2009, 34:10
24. DeGroot J, Verzijl N, Wenting-van Wijk MJ et al., ‘Accumulation of advanced glycation end products as a molecular mechanism for aging as a risk factor in osteoarthritis’,
Arthritis Rheum, 2004, 50:1207
25a. Matsumoto T, Kawakami M, Kuribayashi K et al., ‘Cyclic mechanical stretch stress increases the growth rate and collagen synthesis of nucleus pulposus cells in vitro’,
Spine, 1999, 24:315
25b. Vernon-Roberts B, Fazzalari NL, Manthey BA, ‘Pathogenesis of tears of the anulus investigated by multiple-level transaxial analysis of T12-L1 disc’,
Spine, 1997, 22:2641
26. Hormel SE, Eyre DR, ‘Collagen in the ageing human intervertebral disc. An increase in covalently bound fluorophores and chromophores’,
Biochim Biophys Acta, 1991, 1078:243
27. Nerlich A, Schleicher ED, Boos N, ‘Immunohistologic markers for age‐related changes of human lumbar intervertebral discs. 1997 Volvo Award Winner in Basic Science Studies’,
Spine 1997, 24:2781
28. Sivan SS, Tsitron E, Wachtel E et al., ‘Age-related accumulation of pentosidine in aggrecan and collagen from normal and degenerate human intervertebral discs’,
Biochem J, 2006, 399:29
29. Yasuma T, Koh S, Okamura T et al., ‘Histological changes in aging lumbar vertebral discs’,
J Bone Joint Surg, 1990, 72B:220
30. Yasuma T, Arai K, Suzuki F, ‘ Age-related phenomena in the lumbar intervertebral discs. Lipofuscin and amyloid deposition’,
Spine, 1992, 17:1194
31. Mulholland RC, ‘The myth of lumbar instability and the importance of abnormal loading as a cause of low back pain’,
Eur Spine J, 2008, 17:619
32. Adams MA, Bogduk N, Burton K, Dolan P, ‘The biomechanics of back pain’, Third edition’,
Churchill Livingstone, Elsevier, Edinburgh, 2013:202
33. Frobin W, Brinckmann P, Biggemann M et al., ‘Precision measurement of disc height, vertebral height and sagittal plane displacement from lateral radiographic views of the lumbar spine’,
Clin Biomech, 1997, 12(Suppl 1):S1
34. Frobin W, Brinckmann P, Kramer M et al., ‘Height of lumbar discs measured from radiographs compared with degeneration and height classified from MR images’,
Eur Radiol, 2001, 11:263
35. Shao Z, Rompe G, Schiltenwolf M, ‘Radiographic changes in the lumbar intervertebral discs and lumbar vertebrae with age’,
Spine, 2002, 27:263
36. Saifuddin A, Braithwaite I, White J et al., ‘The value of lumbar magnetic resonance imaging in the demonstration of anular tears’,
Spine, 1998, 23:453
37. Sato K, Kikuchi S, Yonezawa T, ‘In vivo intradiscal pressure measurement in healthy individuals and in patients with ongoing back problems’,
Spine, 1999, 24:2468
38. Osti OL, Vernon-Roberts B, Fraser RD, ‘1990 Volvo Award in experimental studies. Anulus tears and intervertebral disc degeneration. An experimental study using an animal model’,
Spine, 1990, 15:762
39. Adams MA, Dolan P, ‘Could sudden increases in physical activity cause degeneration of intervertebral discs?’,
Lancet, 1997, 350:734
40. Cheung KM, Karppinen J, Chan D et al., ‘Prevalence and pattern of lumbar magnetic resonance imaging changes in a population study of one thousand forty-three individuals’,
Spine, 2009, 34:934
41. Hirsch C, Schajowicz F, ‘Studies on structural changes in the lumbar annulus fibrosus’,
Acta Orthop Scand, 1952, 22:184
42. Badley EM, ‘Epidemiological aspects of the ageing spine’,
In: The Ageing Spine. Hukins DWL, Nelson MA (eds.), Manchester University Press, 1987:1
43. Vernon-Roberts B, ‘Disc pathology and disease states‘,
In: Ghosh P, ‘The biology of the intervertebral disc’,
Boca Raton, Florida, CRC Press, 1988:73
44. Wognum S, Huyghe JM, Baaijens FP, ‘Influence of osmotic pressure changes on the opening of existing cracks in 2 intervertebral disc models’,
Spine, 2006, 31:1783
45. Kanerva A, Kommonen B, Grönblad M et al., ‘Inflammatory cells in experimental intervertebral disc injury‘,
Spine, 1997, 22:2711
46. Tschoeke SK, Hellmuth M, Hostmann A et al., ‘Apoptosis of human intervertebral discs after trauma compares to degenerated discs involving both receptor-mediated and mitochondrial-dependent pathways’,
J Orthop Res, 2008, 26:999
47. Roberts S, Evans EH, Kletsas D et al., ‘Senescence in human intervertebral discs’,
Eur Spine J, 2006, 15(Suppl 3):S312
48. Gruber HE, Ingram JA, Norton HJ et al., ‘Senescence in cells of the aging and degenerating intervertebral disc. Immunolocalization of senescence-associated beta-galactosidase in human and sand rat discs’,
Spine, 2007, 32:321
49. Le Maitre CL, Freemont AJ, Hoyland JA, ‘Accelerated cellular senescence in degenerate intervertebral discs. A possible role in the pathogenesis of intervertebral disc degeneration’,
Arthritis Res Ther, 2007, 9:R45
50. Lotz JC, ‘Animal models of intervertebral disc degeneration. Lessons learned’,
Spine, 2004, 29:2742
51. Weiler C, Schietzsch M, Kirchner T et al., ‘Age-related changes in human cervical, thoracal and lumbar intervertebral disc exhibit a strong intra-individual correlation’,
Eur Spine J, 2012, 21(Suppl 6):S810
52. Schmorl G, Junghanns H, ‘Die gesunde und die kranke Wirbelsäule in Röntgenbild und Klinik. Pathologisch-anatomische Untersuchungen‘, Thieme 1951:141
53. Vernon-Roberts B, Pitie CJ, ‘Degenerative changes in the intervertebral discs of the lumbar spine and their sequelae’,
Rheumatol Rehab, 1977,16:13
54. Melrose J, Ghosh P, Taylor TK et al., ‘A longitudinal study of the matrix changes induced in the intervertebral disc by surgical damage to the annulus fibrosus’,
J Orthop Res, 1992, 10:665
55. Lawrence JS, ‘Disc degeneration. Its frequency and relationship to symptoms’,
Ann Rheum Dis, 1969, 28:121
56. Haefeli M, Klaberer F, Saegesser D et al., ‘The course of macroscopic degeneration in the human lumbar intervertebral disc’,
Spine, 2006, 31:1522
57. Marchand F, Ahmed AM, ‘Investigation of the laminate structure of lumbar disc anulus fibrosus’,
Spine, 1990, 15:402
58. Bernick S, Walker JM, Paule WJ, ‘Age changes to the anulus fibrosus in human intervertebral discs’,
Spine, 1991, 16:520
59. Adams MA, Hutton WC, ‘The relevance of torsion to the mechanical derangement of the lumbar spine’,
Spine, 1981, 6:241
60. Kirkaldy-Willis WH, Farfan HF, ’Instability of the lumbar spine’,
Clin Orthop Relat Res, 1982, 165:110
61. Krismer M, Haid C, Behensky H et al. ‘Motion in lumbar functional spine units during side bending and axial rotation moments depending on the degree of degeneration’,
Spine, 2000, 25:2020
62. Mimura M, Panjabi M, Oxland TR et al., ‘Disc degeneration affects the multidirectional flexibility of the lumbar spine’,
Spine, 1994, 19:1371
63. Fujiwara A, Lim Th, An HS et al., ‘The effect of disc degeneration and facet joint osteoarthritis on the segmental flexibility of the lumbar spine’,
Spine, 2000, 25:3036
64. Farfan HF, Cossette JW, Robertson GH et al., ‘The effects of torsion on the lumbar intervertebral joints. The role of torsion in the production of disc degeneration’,
J Bone Joint Surg, 1970, 51A:468
65. Lin HS, Liu YK, Adams KF, ‘Mechanical response of the lumbar intervertebral joint under physiological (complex) loading’,
J Bone Joint Surg, 1978, 60A:41
66. Osti OL, Vernon-Roberts B, Moore R et al., ‘Annular tears and disc degeneration in the lumbar spine. A post-mortem study of 135 discs’,
J Bone Joint Surg, 1992, 74B:678
67. Buckwalter JA, ‘Aging and degeneration of the human intervertebral disc’,
Spine, 1995, 20:1307
68. Videman T, Nurminen M, ‘The occurrence of anular tears and their relation to lifetime back pain history. A cadaveric study using barium sulfate discography’,
Spine, 2004, 29:2668
69. Kakitsubata Y, Theodorou DJ, Theodorou SJ et al., ‘Magnetic resonance discography in cadavers. Tears of the annulus fibrosus’,
Clin Orthop Relat Res, 2003, 407:228
70. Adams MA, Dolan P, Hutton WC, ‘The stages of disc degeneration as revealed by discograms’,
J Bone Joint Surg, 1986, 68B:36
* Guy Declerck, MD
. 1964, Grieks-Latijnse Humaniora
. 1978, Dokter in de Genees-,Heel-, en Verloskunde (KUL)
. 1983, Medische Specialist in de Orthopedie (KUL & Exeter, UK)
. 1988, Postgraduate Orthopedic Surgery (Plymouth & Liverpool, UK)
. 1989, Spinal Fellow in Adult Spinal Surgery (Perth, Australia)
. 1989, Research Fellow in Spinal Injuries & Rehabilitation (Perth, Australia)
. 1989, Neuromuscular Foundation of Western Australia Postgraduate Studentship
. 1992, Spinaal Orthopedisch Chirurg (Vlaanderen en buitenland)
. 1992, Medical Doctor National Belgian Judo Team
. 1993, European Spine Research Fellowship ‘Bionic Walking’ (Stoke-on-Trent, UK)
. 1994, Worldwide Encyclopaedia Invited Surgeon and SAFIR Spinal Travel Fellowship
. 2003, Rugchirurg-op-rust in Vlaanderen
. 2003-2006, Sabbatical
. 2007-2014, International Spinal Research, Spinal Scientific Advisory Consultant & Instructor
. 2007-now, Consultant Research & Development Innovative & Restorative Spinal Technologies
. 2007-now, Spinal Lecturing & Writing, Surgical Education (www.guy-declerck.com en www.hhp.be/nl/blog)
. 2012-now: President International Association Andullation Therapy (www.iaat.eu/Science)











