Chronische lage rugpijn door grote discusscheuren! Deel 3 Autopsiegegevens
Inhoudsopgave
- Even herhalen! Kleine scheurtjes veroorzaken vooral acute rugpijn
- Chronische lage rugpijn? Wetenschappers weten er weinig over!
- Chronische pijn door letsels in de discussen?
- Scheuren doorheen de volledige annulus = radiale scheuren
- Degeneratieve radiale scheur op MRI
- Wat kan er gebeuren als de annulus volledig doorscheurt?
- Pijnklachten die duiden op degeneratieve radiale annulusscheuren
- Wat ziet men in chirurgisch verwijderde degeneratieve discussen?
- Radiale annulaire scheuren veroorzaken intense lage rugpijn
- Radiale annulaire scheuren veroorzaken zenuwwortelontsteking
- Hoe ontstaan de beenklachten?
- Beenklachten staan niet in verhouding tot wat ‘gezien’ wordt
- Beenklachten zijn te wijten aan ‘pijnsensitisatie’
- Wat veroorzaakt ‘pijnsensitisatie’?
- Wat leerden dierexperimenten ons in dit verband?
- Volledige annulaire scheuren kunnen niet genezen!
- Referenties
Even herhalen! Kleine scheurtjes veroorzaken vooral acute rugpijn
Kleine scheurtjes in de L4-L5 en L5-S1 discussen zijn doorgaans verantwoordelijk voor kortdurende opstoten van lage rugpijn (cf. Blog ‘Acute lage rugpijn? Niet door hernia’s! Wel door kleine scheurtjes!’). Maar om aanhoudende of regelmatig terugkerende pijnklachten in de lage rug (= chronische lage rugpijn) te ontwikkelen, zijn grotere letsels of ernstige pathologieën vereist. Daarenboven kan men slechts bij 15 à 20 % van de personen die chronische lage rugpijn ervaren een duidelijke diagnose stellen (cf. Blog ‘Lage rugpijn: oorzaak slechts in 15 % à 20 % van de gevallen met zekerheid te bepalen’).
Chronische lage rugpijn? Wetenschappers weten er weinig over!
Wetenschappers zijn doorgaans heel geïnteresseerd om kort na overlijden een autopsie uit te voeren in de hoop de oorzaak te achterhalen van tal van menselijke aandoeningen. Met deze informatie proberen ze dan vooral klachtenonderdrukkende of zelfs genezende middelen te ontwikkelen. Voor discusautopsie daarentegen is dit niet het geval! Hier ontbreekt de interesse totaal (cf. Blog ‘Discusproblemen! Wie heeft daar nu interesse voor?’).
Chronische pijn door letsels in de discussen?
In het Departement Neuromusculaire Pathologie aan de Universiteit te Perth, West-Australië1, 2, 3, konden in 1991, na analyse van niet minder dan 23.539 wervelkolommen, systematisch drie types afwijkingen in de discussen vastgesteld worden (schema 1). Vooreerst was er de gekende en universeel voorkomende verbrokkeling van de degenererende discuskern4, 5 (cf. 'Verouderende discussen verschillen sterk van degeneratieve discussen’). De frequent voorkomende grote scheuren doorheen de volledige annulus in de onderste L4-L5 en L5-S1 discussen worden hieronder besproken. Opvallend waren ook de onderbrekingen, scheuren en breuken in de eindplaten van de bovenste discussen L1-L2 en L2-L3. Ze worden in de volgende blog besproken. Discushernia’s waren een uiterste zeldzaamheid. Bulgings daarentegen van de annulus waren schering en inslag. Een zeer belangrijke vaststelling was dat het klachtenpatroon bij deze drie types letsels compleet verschilt van de typische ‘radiculaire’ klachten, veroorzaakt door een discushernia6. De problematiek rond de discushernia wordt in latere blogs besproken.
Waar ? | L1-L2 discus | L2-L3 | L3-L4 | L4-L5 | L5-S1 |
Eindplaatletsels | 21 % | 24 % | 17 % | 8 % | 4 % |
Radiale annulaire letsels | 28 % | 35 % | 50 % | 62 % | 66 % |
Schema 1. Bij autopsie van 23.539 menselijke wervelkolommen werden via analyse van 141.234 discussen (T12-L1 tot L5-S1) zowel ter hoogte van de bovenste eindplaat als in de annulus bijzonder veel letsels aangetroffen die radiologisch zelden konden vastgesteld worden. Het is opvallend dat onderbrekingen in de annulus vooral voorkomen ter hoogte van L4-5 en L5-S1 discussen. Letsels in de eindplaten zijn vooral zichtbaar in de eindplaten van de L1-2 en L2-L3 discussen. Er bestaan dus vermoedelijk twee verschillende processen die onafhankelijk van elkaar de degeneratie van het volledige discusweefsel kunnen uitlokken.
Scheuren doorheen de volledige annulus = radiale scheuren
Discografisch onderzoek bij overleden vijftigjarigen toont aan dat één op drie discussen in de lage rug een scheur vertoont doorheen de volledige annulus zonder aanwezigheid van discushernia’s, maar wel met uitpuilingen van de annulus7. Dit zijn de zogenaamde radiale scheuren. Ze zijn het gevolg van degeneratieve disruptie van de discuskern (IDD), waardoor in eerste instantie degeneratieve scheurtjes ontstaan aan de binnenzijde van de annulus8. Geleidelijk aan breiden zich deze binnenscheurtjes radiaal uit doorheen de andere (nochtans dikker wordende) interne lamellen9, 10, 11, die daarenboven ook van elkaar loskomen12. Hierdoor ontstaan er in de annulus steeds meer barsten en holtes13, 14. De zogenaamde in-to-out- scheuren15, 16, 17, 18 verlopen horizontaal tot aan de buitenste zone van de annulus vooraleer deze onmiddellijk te doorboren19, 20 (Fig. 1). Hoe verder de degeneratie zich radiaal uitbreidt, hoe meer kans op het ontstaan van lage rugpijn7, 21. Deze radiale scheuren ontwrichten op hun beurt de resterende interne structuur van de discus. Ook de annulus zelf wordt hierdoor poreuzer. Dit laat toe dat ontstekingsfactoren die in de degenererende discuskern ontstaan, in het ruggenmerganaal doordringen en zo diffuse klachten in het been (en soms onderbeen) veroorzaken. Deze beenklachten verschillen compleet van klachten die door supplementaire druk van bijvoorbeeld een hernia veroorzaakt worden (zie hieronder).
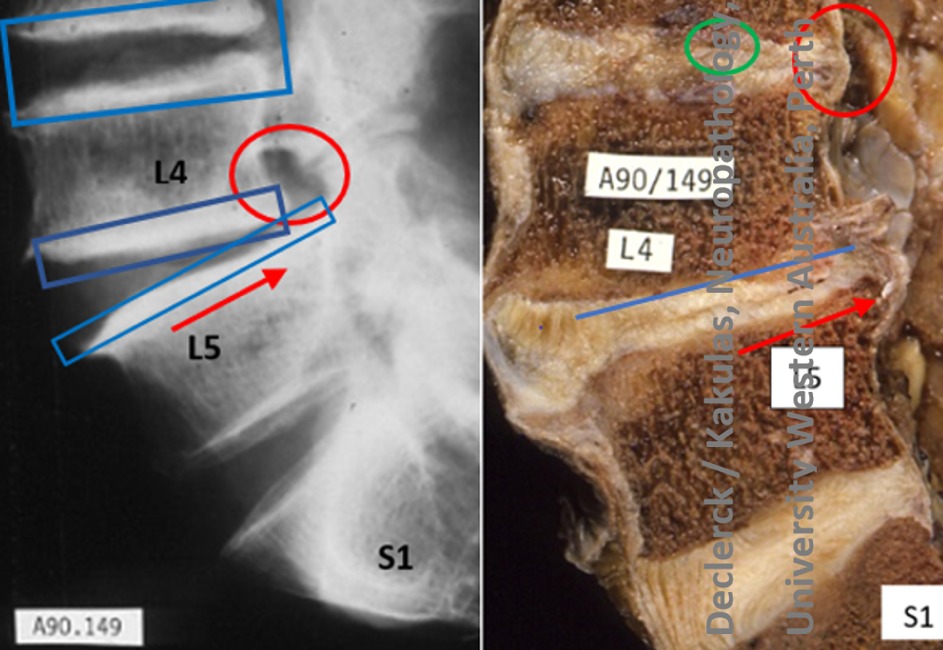
Fig. 1. De radiologische beelden duiden op een vernauwing van de discusruimte t. h. v. de L3-L4 en vooral t. h. v. L4-L5. Deze is het belangrijkste zichtbare teken dat het degeneratieproces in de verouderende discussen gestart is. T. h. v. L4-L5 heeft dit proces reeds geleid tot een verschuiving tussen de aanpalende wervels (rode pijl) met ook een verkleining van de ruimte waar de zenuwwortel loopt (rode cirkel). Er is zeker ook reeds vergevorderde verbening van de discuseindplaten (blauwe rechthoeken). Op het rechter autopsiebeeld van de wervelkolom van dezelfde persoon is de discogene degeneratie t. h. v. L3-L4 veel minder sterk uitgesproken dan t. h. v. L4-L5. T. h. v. L3-L4 is in de buitenste annulus een scheur zichtbaar samen met een lichte bulging (rode cirkel). Er is vermoedelijk ook reeds een scheur in de eindplaat (groene cirkel). Omdat deze eindplaatonderbreking belangrijke inflammatoire gevolgen heeft voor het beenweefsel van de aanpalende wervel, werden supplementaire seriële overlangse secties uitgevoerd om deze fenomenen aan te tonen. Ze worden besproken in de volgende blog. In de L4-L5 discus is een horizontale radiale scheur zichtbaar die uitgaat van de kern en doorheen de volledige annulus loopt (parallel onder de blauwe lijn). Deze annulus puilt uit in het ruggenmergkanaal zonder vorming van een hernia. De verschuiving tussen de wervels is overduidelijk (rode pijl). Op het autopsiebeeld van de L5-S1 discus zijn slechts verouderingsfenomenen zichtbaar met vooraan vooral de duidelijke versteviging van de collagene lamellen (X90/149 - M/79 - Declerck / Kakulas, Neuropathology, University Western Australia, Perth).
Degeneratieve radiale scheur op MRI
Op MRI zijn de degeneratieve scheuren doorheen de volledige annulus duidelijk zichtbaar als ‘high intensity zones’ (Fig. 2). Telkens is ook een discusbulging zichtbaar22. Deze radiale scheuren komen veel frequenter voor ter hoogte van de onderste twee L4-L5 en L5-S1 discussen omdat in hun kernen veel sneller fibrose (= littekenweefsel) gevormd wordt23. Deze scheuren zijn doorgaans de voorbode van aanhoudende (= chronisch) invaliderende lage rugpijn met veel minder intense lasten in de benen24.
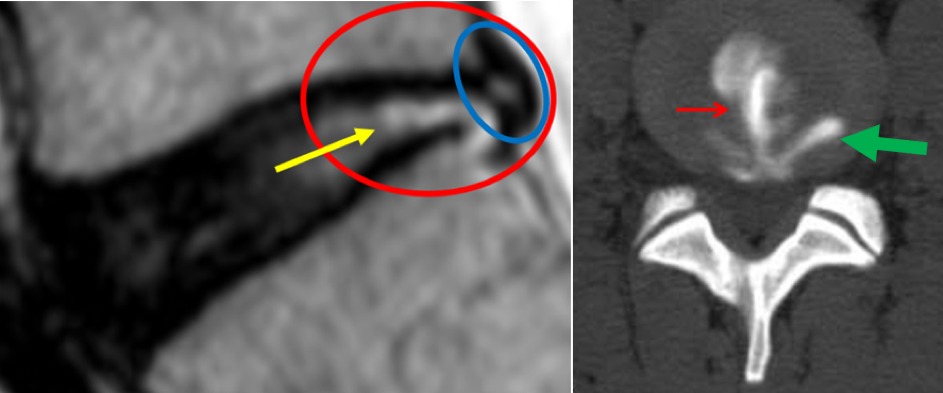
Fig. 2. Afbeeldingen met toestemming diensthoofd Radiologie in 2017, ASZ, Aalst, België. Het MRI-beeld ter hoogte van de onderste L5-S1 discus toont een duidelijke radiale scheur in de annulus (Li: rode cirkel; Re: rode pijl) alsook een uitpuilende bulging (Li: blauwe cirkel). In MRI-taal noemt men de zichtbare witte streep een ‘high intensity zone’. Ongeveer 40 % van degenen die chronische lage rugpijn ervaren, vertonen een dergelijk beeld25, 26. De scheur startte in het centrum van de discus en breidde zich uit richting achterzijde van de discus (Li: gele pijl). Op dit beeld lijken de buitenste lamellen nog intact (blauwe cirkel) maar is een duidelijke concentrische scheur wat duidt op loslating van de lamellen (Re: groene pijl). Men noemt deze ‘radiologisch witte’ scheuren ‘in-to-out-scheuren’. Ze komen meestal voor ter hoogte van de L4-L5 en L5-S1 discussen (26, 27).
Wat kan er gebeuren als de annulus volledig doorscheurt?
Behalve als gevolg van extreem destructieve krachten, bv. door een zwaar ongeval (Fig. 3), worden volledige radiale scheuren in de regel veroorzaakt door degeneratieve fenomenen uitgaande van de discuskern21, 28, 29, 30a. Omdat discussen levenslang op identieke manier belast worden (en zeker tijdens repetitieve voorovergebogen activiteiten 30b), kan het resterend degeneratief materiaal uit de discuskern - indien nog niet grotendeels verteerd - dan mogelijks doorheen de gescheurde collageenvezels van de annulaire lamellen in richting ruggenmergkanaal geperst worden. Door migratie van dit degeneratief materiaal breken nog meer lamellen af zodat dit materiaal uiteindelijk in het ruggenmergkanaal terechtkomt. Zo vormt zich een degeneratieve discushernia.
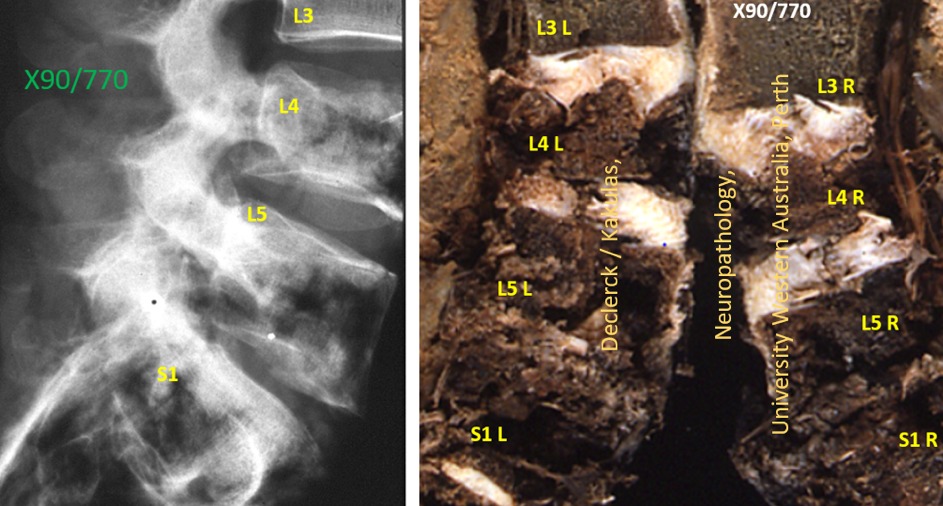
Fig. 3. Volledige vermorzeling van de L4, L5 en S1 wervels. De hoge impact van het accident veroorzaakte naast complexe fracturen ook een destructie van de bovenste eindplaat van de L4-wervel. De L4-L5 discus is afgescheurd van de L4-wervel en doormidden gescheurd. De L5-S1 discus is volledig vermorzeld en quasi niet meer zichtbaar omdat daarenboven de L5-wervel naar achteren is verschoven ten opzichte van het heiligbeen (S1). (Declerck / Kakulas, Neuropathology, University Western Australia, Perth X90/770 - M/37).
Pijnklachten die duiden op degeneratieve radiale annulusscheuren
Degeneratieve radiale annulusscheuren worden gekenmerkt door lage rugpijn die veel intenser is dan de diffuse maar minder erge lasten in de benen. Dit klachtenpatroon verschilt compleet van datgene dat door een discushernia veroorzaakt wordt. Omdat een hernia ook rechtstreekse druk uitoefent op één of meerdere zenuwwortels, is de pijn veroorzaakt in het been veel meer invaliderend dan de pijnlijke lasten in de lage rug. Daarenboven veroorzaakt een hernia objectief vast te stellen verlammingsverschijnselen die een duidelijk neurologisch patroon volgen (= radiculair ischiadiform)6.
Het klachtenpatroon bij degeneratieve radiale discusscheuren komt doorgaans voor bij personen ouder dan 30 jaar. Ze vertellen dat ze als gevolg van langdurig vooroverbuigen en/of optillen van een of ander voorwerp (niet noodzakelijk zwaar!) lage rugpijn ervoeren die geleidelijk aan over meerdere dagen steeds intenser werd26, 27, 31, 32. Bij klinische ondervraging en onderzoek vertonen radiale scheuren geen enkele klacht of teken van een discushernia33.
Wat ziet men in chirurgisch verwijderde degeneratieve discussen?
Wanneer degeneratieve discussen na heelkundige verwijdering microscopisch onderzocht worden, stelt men twee fenomenen vast die compleet van elkaar verschillen.
Enerzijds bemerkt men een chronische ontsteking die evolueert vanuit de kern in de richting van de annulus. Het afbraakmateriaal uit de degenererende discuskern dat ook steeds meer ontstekingsfactoren produceert (zie hieronder), migreert doorheen de radiale annulaire scheuren en dringt door of wordt dan in het ruggenmergkanaal geperst, zodat het in contact komt met zenuwtjes in de buitenste annulus en met de zenuwwortel(s).
Anderzijds worden talrijke annulaire scheuren opgevuld met littekenweefsel dat doorspekt is met nieuwe bloedvaatjes (= neovascularisatie), vergezeld van nieuwe pijngevoelige zenuwvezeltjes (= neoinnervatie). Deze neovascularisatie en neoinnervatie evolueert vanaf de buitenzijde van de annulus in de richting van de discuskern34, 35.
Radiale annulaire scheuren veroorzaken intense lage rugpijn
Net zoals bij ‘herstel’ van kleine scheurtjes aan de buitenzijde van de annulus, groeien er tijdens het ‘herstel’ van volledige radiale scheuren, naast bloedvaatjes, ook heel wat pijngevoelige zenuwvezeltjes in het littekenweefsel36, 37, 38, 39, 40, 41.
In normale en gezonde discussen verhinderen de hoge hoeveelheden suikereiwitten dat er bloedvaatjes en zenuwtjes in de discus kunnen binnendringen42, 43. Wanneer daarentegen meer en meer suikereiwitten afgebroken worden, produceren de resterende cellen in de degenererende kern en annulus zogenaamde neurotrofische factoren die zenuwcellen aantrekken44, 45, 46, 47. De binnendringende zenuwtjes eindigen ofwel vrij tussen de collagene vezels in de annulus, of migreren verder tot in de degeneratieve kern. Omdat de voeding van zenuwen afhankelijk is van bloedvaatjes, volgen de zenuwtjes de progressie van de bloedvaatjes.
In tegenstelling tot een gezonde discus, bevat niet alleen de degeneratieve annulus maar ook de degeneratieve discuskern veel zenuwtjes48. Daarom zijn de volledige radiale scheuren in de annulus een van de belangrijkste redenen voor het ontstaan en bestaan van frequent optredende lage rugpijn7, 37, 47 die zelfs aanwezig kan zijn vóór het 20ste levensjaar7.
Radiale annulaire scheuren veroorzaken zenuwwortelontsteking.
Een typisch biochemisch fenomeen dat optreedt naarmate de degeneratie van de discuskern evolueert, is de toenemende hoeveelheid destructieve enzymen en ontstekingsfactoren (MMP’s, aggrecanasen en cytokines)9, 50, 51, 52. Ze breken in de discuskern niet alleen collagene vezels af, maar ook suikereiwitten (= proteoglycanen ). Dit proces houdt jarenlang aan tot de kern volledig verdwenen is53, 54, 55, 56. Het resorptieproces van de discus wordt in de volgende blogs verduidelijkt.
Hoe ontstaan de beenklachten?
Niet iedereen bij wie discusdegeneratie met radiale scheuren radiologisch zichtbaar is, vertoont klachten in het been (en onderbeen). Maar zelfs wanneer slechts een minimale hoeveelheid van dergelijke chemische substanties uit de degeneratieve kern doorheen de poreuze annulaire scheur in het ruggenmergkanaal sijpelt of migreert, kunnen er in het been (en onderbeen) ook eigenaardige klachten ontstaan. Men maakt gewag van gevoelens van warmte, koude, kriebels, voosheid, vermoeidheid e. d., die over de heupkammen uitstralen naar de liezen en de binnenzijde van de dijen. Wanneer de zenuwwortels slechts door een dergelijke chemische ontstekingsreactie geïrriteerd worden, vermeldt men veel minder invaliderende pijnen dan wanneer de zenuwwortels ook nog supplementair platgedrukt worden door mechanische druk van een discushernia. In dit laatste geval klaagt men voornamelijk over zeer intense pijnen in het onderbeen die veel erger zijn dan de pijn in de lage rug en zich daarenboven voordoen volgens een doorgaans duidelijk op ischias lijkend patroon (= ischialgie)33, 57.
Beenklachten staan niet in verhouding tot wat ‘gezien’ wordt.
Bij volledige annulaire scheuren staan de klachten in het onderbeen niet in verhouding tot het klinisch onderzoek en de radiologische bevindingen. Er zijn geen verlammingsverschijnselen aanwezig. Op CAT en MRI is geen hernia te ‘zien’, wel slechts een bulging22. Tijdens operatie vindt men ook geen hernia58.
Tijdens heelkundige exploraties vertonen deze zenuwwortels niet langer hun normale geelachtige kleur maar komen ze wit voor en voelen ze harder aan. Deze veranderingen zijn ook de reden voor het uitlokken van pijn onder het knieniveau60, 61, 62.
Beenklachten zijn te wijten aan ‘pijnsensitisatie’
Bij volledige scheuren doorheen de annulus ontstaan klachten in het been (en soms het onderbeen) door wat men ‘pijnsensitisatie’ noemt. Dit wordt veroorzaakt door afbraakproducten die vanuit de degeneratieve discuskern doorheen de annulaire scheur in het ruggenmergkanaal terechtkomen63. Zoals vermeld is slechts een kleine hoeveelheid lekkend materiaal voldoende om ontstekingen van de zenuwwortels te veroorzaken.
Wat veroorzaakt ‘pijnsensitisatie’?
In het lekkende degeneratieve weefsel uit de discuskern zijn scheikundige mediatoren aanwezig (cytokines zoals TNFα en stifstofoxide) die ontstekingen van de zenuwwortels kunnen veroorzaken44, 60, 64, 65, 66, 67, 68, 69, 70. Wanneer men bij dierexperimenten deze cytokines blokkeert, verminderen de schadelijke effecten van de discuskern op de zenuwwortels62, 69, 71, alsook de beenpijnen72, 73, 74, 75.
Wat leerden ons dierexperimenten in dit verband?
Naast radiologisch zichtbare mechanische druk door een hernia kunnen ook niet-zichtbare chemische factoren verantwoordelijk zijn voor allerlei klachten in de onderste ledematen57, 76. Wanneer men bij experimenten met varkens en honden dergelijk degeneratief discuskernmateriaal zonder enige druk gewoon op de zenuwwortels neerlegt, dan ontstaan er afwijkingen in hun structuur die de zenuwfunctie zullen verstoren76, 77. Er ontstaan ontstekingen78, 79 die de bloedvoorziening rond deze zenuwwortels verminderen, waardoor littekenweefsel gevormd wordt65, 80, 81, 82, 83. Dit alles leidt tot pijngedrag bij testdieren84, 85, 86, 87.
Volledige annulaire scheuren kunnen niet genezen!
Eenmaal aan de binnenzijde van de annulus degeneratieve scheuren optreden, evolueren ze steeds verder doorheen de volledige annulus88. Omdat de kern ook factoren produceert die bloedvoorziening verhindert55, kunnen de collagene lamellen en de unieke lamellaire structuur van de annulus niet meer ‘genezen’89. Tijdens het natuurlijke ‘herstel’ groeien in het binnentredend littekenweefsel voldoende kleine bloedvaatjes, vergezeld van pijngevoelige zenuwvezeltjes42, 43, 90, 91, 92, 93, 94, 95, 96. Deze neovascularisatie en neoinnervatie van de annulus vormen zeer waarschijnlijk de reden waarom deze ‘herstelde’ scheuren chronische lage rugpijn uitlokken34, 37.
In volgende blog wordt uitgelegd waarom evoluerende degeneratieve scheuren en/of eindplaatbreuken in de discus eveneens de oorzaak kunnen zijn van aanhoudende of recurrente opstoten van lage rugpijn.
Referenties
- https://perroninstitute.org/p/emeritus-professor-byron-a-kakulas-ao
- https://en.wikipedia.org/wiki/George_Bedbrook
- Kakulas BA, Bedbrook GM, ‘Pathology of injuries of the vertebral column with emphasis on the macroscopical aspects’, In: Vinken PJ, Bruyn GW, Handbook of clinical neurology. Volume 25. Injuries of the spine and spinal cord, Part I, 1976:27
- Lindblom K, ‘Intervertebral disc degeneration considered as a pressure atrophy’,
J Bone Joint Surg, 1957, 39A:933 - Mulholland RC, ‘The myth of lumbar instability. The importance of abnormal loading as a cause of low back pain’,
Eur Spine J 2008, 17:619-625 - Mixter WJ, Barr JS, ‘Rupture of the intervertebral disc with involvement of the spinal canal’,
N Engl J Med, 1934, 211 :210 - Videman T, Nurminen M, ‘The occurrence of anular tears and their relation to lifetime back pain history. A cadaveric study using barium sulfate discography’,
Spine, 2004, 29:2668 - Osti OL, Vernon-Roberts B, Moore R et al., ‘Annular tears and disc degeneration in the lumbar spine. A post-mortem study of 135 discs’,
J Bone Joint Surg, 1992, 74B:678 - Bogduk N, ‘The lumbar disc and low back pain’,
Neurosurg Clin N Am, 1991, 2:791 - Nerlich AG, Schleicher ED, Boos N, ‘1997 Volvo Award winner in basic science studies. Immunohistologic markers for age-related changes of human lumbar intervertebral discs’,
Spine, 1997, 22:2781 - Boos N, Weissbach S, Rohrbach H et al., ‘Classification of age-related changes in lumbar intervertebral discs. 2002 Volvo Award in basic science’,
Spine, 2002, 27:2631 - Vernon-Roberts B, Fazzalari NL, Manthey BA, ‘Pathogenesis of tears of the anulus investigated by multiple-level transaxial analysis of T12-L1 disc’,
Spine, 1997, 22:2641 - Hirsch C, Schajowicz F, ‘Studies on structural changes in the lumbar annulus fibrosus’,
Acta Orthop Scand, 1953, 22:184 - Buckwalter JA, ‘Aging and degeneration of the human intervertebral disc’,
Spine, 1995, 20:1307 - Brinckmann P, ‘Injury of the annulus fibrosus and disc protrusions. An in vitro investigation on human lumbar discs’,
Spine, 1986, 11:149 - Brinckmann P, Biggeman M, Hilweg D, ‘Fatigue fracture of human lumbar vertebrae’,
Clin Biomech, 1988, 3(Suppl 1):S1 - Brinckmann P, Biggeman M, Hilweg D, ‘Prediction of the compressive strength of human lumbar vertebrae’,
Spine, 1989, 14:606 - Brinckmann P, Frobin W, Biggeman M et al., ‘Quantification of overload injuries to thoracolumbar vertebrae and discs in persons exposed to heavy physical exertions or vibration at the workplace Part II Occurrence and magnitude of overload injury in exposed cohorts’,
Clin Biomech, 1998, 13(Suppl 2):S1 - Gruber HE, Hanley EN Jr, ‘Analysis of aging and degeneration of the human intervertebral disc. Comparison of surgical specimens with normal controls’,
Spine, 1998, 23:751 - Gruber HE, Hanley EN Jr, ‘Ultrastructure of the human intervertebral disc during aging and degeneration. Comparison of surgical and control specimens’,
Spine, 2002, 27:798 - Moneta GB, Videman T, Kaivanto K et al. ‘Reported pain during lumbar discography as a function of annular ruptures and disc degeneration: a re-analysis of 833 discograms’,
Spine, 1994, 19:1968 - Yu SW, Haughton VM, Sether LA et al., ‘Annulus fibrosus in bulging intervertebral discs’,
Radiology, 1988, 169:761 - Friberg S, Hirsch C, ‘Anatomical and clinical studies on lumbar disc degeneration’,
Acta Orthop Scand, 1949, 19:222 - Salminen JJ, Erkintalo MO, Pentti J et al., ‘Recurrent low back pain and early disc degeneration in the young’,
Spine, 1999, 24:1316 - Schwarzer AC, Aprill CN, Derby R et al., 'The prevalence and clinical features of internal disc disruption in patients with chronic low back pain’,
Spine, 1995; 20:1878 - Adams MA, Bogduk N, Burton K, Dolan P, ‘The biomechanics of back pain. Third edition’,
Churchill Livingstone, Elsevier, 2013:203 - Kaila-Kangas L, Leino-Arjas P, Karppinen J et al., ‘History of physical work exposures and clinically diagnosed sciatica among working and nonworking Finns aged 30 to 64’,
Spine, 2009, 34:964 - Vernon-Roberts B, Pitie CJ, ‘Degenerative changes in the intervertebral discs of the lumbar spine and their sequelae’,
Rheumatol Rehab, 1977, 16:13 - Videman T, Nurminen M, Troup JD, ‘Lumbar spinal pathology in cadaveric material in relation to history of back pain, occupation, and physical loading. 1990 Volvo Award in clinical sciences’,
Spine, 1990, 15:728 - A) Haefeli M, Klaberer F, Saegesser D et al., ‘The course of macroscopic degeneration in the human lumbar intervertebral disc’,
Spine, 2006, 31:1522
B) Pezowicz CA, Schechtman H, Robertson PA et al., ‘Mechanisms of anular failure resulting from excessive intradiscal pressure. A microstructural-micromechanical investigation’,
Spine, 2006, 31:2891 - Adams MA, Dolan P, ‘Could sudden increases in physical activity cause degeneration of intervertebral discs?’,
Lancet, 1997, 350:734 - Cheung KM, Samartzis D, Karppinen J et al., ‘Intervertebral disc degeneration. New insights based on "skipped" level disc pathology’,
Arthritis Rheum, 2010, 62:2392 - Jönsson B, ‘Lumbar nerve root compression syndromes. Symptoms, signs and surgical results’,
Thesis University of Lund, 1985, Lund, Sweden - Vernon-Roberts B, Moore RJ, Fraser RD, ‘The natural history of age-related disc degeneration. The pathology and sequelae of tears’,
Spine, 2007, 32:2797 - Peng B, Chen J, Kuang Z et al., ’Expression and role of connective tissue growth factor in painful disc fibrosis and degeneration’,
Spine, 2009, 34:E178 - Coppes MH, Marani E, Thomeer RT et al., ‘Innervation of "painful" lumbar discs’,
Spine, 1997, 22:2342 - Freemont AJ, Peacock TE, Goupille P et al., ‘Nerve ingrowth into diseased intervertebral disc in chronic back pain’,
Lancet, 1997, 350:178 - Melrose J, Roberts S, Smith S et al., ‘Increased nerve and blood vessel ingrowth associated with proteoglycan depletion in an ovine anular lesion model of experimental disc degeneration’,
Spine, 2002, 27 :1278 - Nerlich AG, Schaaf R, Wälchli B et al., ’Temporo-spatial distribution of blood vessels in human lumbar intervertebral discs’,
Eur spine J, 2007, 16:547 - Peng B, Hao J, Hou S et al., ‘Possible pathogenesis of painful intervertebral disc degeneration’,
Spine, 2006, 31:560 - Fagan AB, Sarvestani G, Moore RJ et al., ‘Innervation of anulus tears. An experimental animal study’,
Spine, 2010, 35:1200 - Johnson WE, Caterson B, Eisenstein SM et al., ‘Human intervertebral disc aggrecan inhibits endothelial cell adhesion and cell migration in vitro’,
Spine, 2005, 30:1139 - Johnson WE, Caterson B, Eisenstein SM et al., ‘Human intervertebral disc aggrecan inhibits nerve growth in vitro’,
Arthritis Rheum, 2002, 46:2658 - Cavanaugh JM, ‘Neural mechanisms of lumbar pain’
Spine, 1995,20:1804 - Johnson WE, Sivan S, Wright KT et al., ‘Human intervertebral disc cells promote nerve growth over substrata of human intervertebral disc aggrecan’,
Spine, 2006, 31:1187 - Freemont AJ, Watkins A, Le Maitre C et al., ‘Nerve growth factor expression and innervation of the painful intervertebral disc’,
J Pathol, 2002, 197:286 - Yamauchi K, Inoue G, Koshi T et al., ‘Nerve growth factor of cultured medium extracted from human degenerative nucleus pulposus promotes sensory nerve growth and induces substance P in vitro’,
Spine, 2009, 34:2263 - Adams MA, Bogduk N, Burton K, Dolan P, ‘The biomechanics of back pain. Third edition’,
Edinburgh, Churchill Livingstone, Elsevier, 2013:204 - Adams MA, Bogduk N, Burton K, Dolan P, ‘The biomechanics of back pain. Third edition’,
Edinburgh, Churchill Livingstone, Elsevier, 2013:199 - Adams MA, McNally DS, Wagstaff J et al., ‘Abnormal stress concentrations in lumbar intervertebral discs following damage to the vertebral bodies: a cause of disc failure?’,
Eur Spine J, 1993, 1:214 - Adams MA, Freeman BJ, Morrison HP et al., ‘Mechanical initiation of intervertebral disc degeneration’,
Spine, 2000, 25:1625 - Albert HB, Manniche C, ‘Modic changes following lumbar disc herniation’,
Eur Spine J, 2007, 16:977 - Antoniou J, Steffen T, Nelson F et al., ‘The human lumbar intervertebral disc. Evidence for changes in the biosynthesis and denaturation of the extracellular matrix with growth, maturation, ageing, and degeneration’,
J Clin Invest, 1996, 98:996 - Roberts S, Caterson B, Menage J et al., ‘Matrix metalloproteinases and aggrecanase. Their role in disorders of the human intervertebral disc’,
Spine, 2000, 25:3005 - Reddi AH, Kuettner KE, ‘Vascular invasion of cartilage. Correlation of morphology with lysozyme, glycosaminoglycans, protease, and protease-inhibitory activity during endochondral bone development’,
Dev Biol, 1981, 82:217 - www.guy-declerck.com / Lumbar intervertebral disc / Extracellular matrix ECM / Two major classes of degrading enzymes in ECM
- Takahashi N, Yabuki S, Aoki Y et al., ‘Pathomechanisms of nerve root injury caused by disc herniation. An experimental study of mechanical compression and chemical irritation’,
Spine, 2003, 28:435 - Kawakami M, Tamaki T, Hayashi N et al., ‘Possible mechanism of painful radiculopathy in lumbar disc herniation’,
Clin Orthop Relat Res, 1998, 351:241 - Specchia N, Pagnotta A, Toesca A et al., ‘Cytokines and growth factors in the protruded intervertebral disc of the lumbar spine’,
Eur Spine J, 2002, 11:145 - Aoki Y, Rydevik B, Kikuchi S, Olmarker K, ‘Local application of disc-related cytokines on spinal nerve roots’,
Spine, 2002, 27:1614 - Burke JG, Watson RW, McCormack D et al., ‘Spontaneous production of monocyte chemoattractant protein-1 and interleukin-8 by the human lumbar intervertebral disc’,
Spine, 2002, 27:1402 - Olmarker K, Rydevik B, ‘Selective inhibition of tumor necrosis factor-alpha prevents nucleus pulposus-induced thrombus formation, intraneural edema, and reduction of nerve conduction velocity. Possible implications for future pharmacologic treatment strategies of sciatica’,
Spine, 2001, 26:863 - Iwabuchi M, Rydevik B, Kikuchi S et al., ‘Effects of anulus fibrosus and experimentally degenerated nucleus pulposus on nerve root conduction velocity. Relevance of previous experimental investigations using normal nucleus pulposus’,
Spine, 2001, 26:1651 - Olmarker K, Byröd G, Cornefjord M et al., ‘Effects of methylprednisolone on nucleus pulposus-induced nerve root injury’,
Spine, 1994,19:1803 - Olmarker K, Blomquist J, Strömberg J et al., ‘Inflammatogenic properties of nucleus pulposus’,
Spine, 1995,20:665 - Olmarker K, Nordborg C, Larsson K et al., ‘Ultrastructural changes in spinal nerve roots induced by autologous nucleus pulposus’,
Spine, 1996, 21:411 - Olmarker K, Brisby H, Yabuki S et al., ‘The effects of normal, frozen, and hyaluronidase-digested nucleus pulposus on nerve root structure and function’,
Spine, 1997,22:471 - Olmarker K, Larsson K, ‘Tumor necrosis factor alpha and nucleus-pulposus-induced nerve root injury’,
Spine, 1998, 23:2538 - Brisby H, Byröd G, Olmarker K et al., ‘Nitric oxide as a mediator of nucleus pulposus-induced effects on spinal nerve roots’, J Orthop Res, 2000, 18:815
- Igarashi T, Kikuchi S, Shubayev V et al., ‘2000 Volvo Award winner in basic science studies. Exogenous tumor necrosis factor-alpha mimics nucleus pulposus-induced neuropathology. Molecular, histologic, and behavioral comparisons in rats’,
Spine, 2000, 25:2975 - Evashwick-Rogler TW, Lai A, Watanabe H et al., ‘Inhibiting tumor necrosis factor‐alpha at time of induced intervertebral disc injury limits long‐term pain and degeneration in a rat model’,
JOR, 2018, 1:e1014 - doi: 10.1002/jsp2.1014 - Olmarker K, Nutu M, Størkson R, ‘Changes in spontaneous behavior in rats exposed to experimental disc herniation are blocked by selective TNF-alpha inhibition’,
Spine, 2003, 28:1635 - Onda A, Yabuki S, Kikuchi S, ‘Effects of neutralizing antibodies to tumor necrosis factor-alpha on nucleus pulposus-induced abnormal nociresponses in rat dorsal horn neurons’,
Spine, 2003, 28:967 - Yamashita M, Ohtori S, Koshi T et al., ‘Tumor necrosis factor-alpha in the nucleus pulposus mediates radicular pain, but not increase of inflammatory peptide, associated with nerve damage in mice’,
Spine, 2008, 33:1836 - Zhang Y, Chee A, Thonar EJ et al., ‘Intervertebral disk repair by protein, gene, or cell injection. A framework for rehabilitation-focused biologics in the spine’,
doi: 10.1016/j.pmrj.2011.04.020 - Olmarker K, Rydevik B, Nordborg C, ‘Autologous nucleus pulposus induces neurophysiologic and histologic changes in porcine cauda equina nerve roots’,
Spine, 1993, 18:1425 - Kayama S, Konno S, Olmarker K et al., ‘Incision of the anulus fibrosus induces nerve root morphologic, vascular, and functional changes. An experimental study’,
Spine, 1996, 21:2539 - Habtemariam A, Virri J, Grönblad M et al., ‘Inflammatory cells in full-thickness anulus injury in pigs. An experimental disc herniation animal model’,
Spine, 1998, 23:524 - Geiss A, Larsson K, Rydevik B et al., ‘Autoimmune properties of nucleus pulposus. An experimental study in pigs’,
Spine, 2007, 32:168 - Jayson MI, Keegan A, Million R et al., ‘A fibrinolytic defect in chronic back pain syndromes’,
Lancet, 1984, 2:1186 - Klimiuk PS, Pountain GD, Keegan AL et al., ‘Serial measurements of fibrinolytic activity in acute low back pain and sciatica’,
Spine, 1987, 12:925 - Hoyland JA, Freemont AJ, Jayson MI, ‘Intervertebral foramen venous obstruction. A cause of periradicular fibrosis?’,
Spine, 1989, 14:558 - Cooper RG, Freemont AJ, Hoyland JA et al., ‘Herniated intervertebral disc-associated periradicular fibrosis and vascular abnormalities occur without inflammatory cell infiltration’,
Spine, 1995, 20:591 - Hou SX, Tang JG, Chen HS et al., ‘Chronic inflammation and compression of the dorsal root contribute to sciatica induced by the intervertebral disc herniation in rats’,
Pain, 2003, 105:255 - Kawakami M, Hashizume H, Nishi H et al., ‘Comparison of neuropathic pain induced by the application of normal and mechanically compressed nucleus pulposus to lumbar nerve roots in the rat’,
J Orthop Res, 2003, 21:535 - Olmarker K, Iwabuchi M, Larsson K et al., ‘Walking analysis of rats subjected to experimental disc herniation
Eur Spine J, 1998, 7:394 - Onda A, Murata Y, Rydevik B et al., ‘Nerve growth factor content in dorsal root ganglion as related to changes in pain behavior in a rat model of experimental lumbar disc herniation’,
Spine, 2005, 30:188 - Osti OL, Vernon-Roberts B, Fraser RD, ‘Anulus tears and intervertebral disc degeneration. An experimental study using an animal model. 1990 Volvo Award in experimental studies’,
Spine, 1990, 15:762 - Adams MA, Bogduk N, Burton K, Dolan P, ‘The biomechanics of back pain. Third edition’,
Edinburgh, Churchill Livingstone, 2013:85 - Brodin H, Paths of nutrition in articular cartilage and intervertebral discs’,
Acta Orthop Scand, 1955, 24:177 - Malinsky J, ‘The ontogenetic development of nerve terminations in the intervertebral discs of man’,
Acta Anat, 1959,38:96 - Nachemson A, Lewin T, Maroudas A et al., ‘In vitro diffusion of dye through the end-plates and the annulus fibrosus of human lumbar inter-vertebral discs’,
Acta Orthop Scand, 1970, 41:589 - Rabischong P, Louis R, Vignaud J et al., ‘The intervertebral disc’,
Anat Clib, 1978, 1 :55 - Yoshizawa H, O’Brien JP, Smith WT et al., ‘The neuropathology of intervertebral discs removed for low-back pain’,
J Pathol, 1980, 132:95 - Ogata K, Whiteside LA, 'Nutritional pathways of the intervertebral disc. An experimental study using hydrogen washout technique’,
Spine, 1981, 6:211 - Ferguson SJ, Ito K, Nolte LP, ‘Fluid flow and convective transport of solutes within the intervertebral disc’
J Biomech, 2004, 37:213
* Guy Declerck, MD
- 1964, Grieks-Latijnse Humaniora
- 1978, Dokter in de Genees-,Heel-, en Verloskunde (KUL)
- 1983, Medische Specialist in de Orthopedie (KUL & Exeter, UK)
- 1988, Postgraduate Orthopedic Surgery (Plymouth & Liverpool, UK)
- 1989, Spinal Fellow in Adult Spinal Surgery (Perth, Australia)
- 1989, Research Fellow in Spinal Injuries & Rehabilitation (Perth, Australia)
- 1989, Neuromuscular Foundation of Western Australia Postgraduate Studentship
- 1992, Spinaal Orthopedisch Chirurg (Vlaanderen en buitenland)
- 1992, Medical Doctor National Belgian Judo Team
- 1993, European Spine Research Fellowship ‘Bionic Walking’ (Stoke-on-Trent, UK)
- 1994, Worldwide Encyclopaedia Invited Surgeon and SAFIR Spinal Travel Fellowship
- 2003, Rugchirurg-op-rust in Vlaanderen
- 2003-2006, Sabbatical
- 2007-2014, International Spinal Research, Spinal Scientific Advisory Consultant & Instructor
- 2007-now, Consultant Research & Development Innovative & Restorative Spinal Technologies
- 2007-now, Spinal Lecturing & Writing, Surgical Education (www.guy-declerck.com en www.hhp.be/nl/blog)
- 2012-now: President International Association Andullation Therapy (www.iaat.eu/Science)