Acute lage rugpijn? Niet door hernia’s! Wel door kleine scheurtjes! Deel 2 Autopsiegegevens
Inhoudsopgave
De annulaire vezelring: wat is dat precies? Even herhalen!
De annulus is, als sterkste mechanische structuur in het lichaam, niet opgewassen tegen de continu belastende verticale krachten
Tijdens autopsies ziet men bijzonder veel annulaire scheuren
Annulaire scheuren komen voor op alle leeftijden
Annulaire scheuren komen op MRI voor als ‘high intensity zones’
Scheuren in het buitenste deel van annulus kunnen ontstaan zonder tekenen van degeneratie in de kern
Scheuren in het buitenste deel van annulus – ‘outer annular tears’ – ontstaan doorgaans als gevolg van ‘extreme’ bewegingen
Experimentele scheuren in de buitenste annulus bij dieren initiëren of versnellen wél het degeneratieproces in de kern van de discus
Experimentele scheuren in buitenste annulus genezen niet.
Er groeien ook pijngevoelige zenuwvezeltjes in!
Hoe evolueren de buitenste scheuren in de annulus van de mens?
Wat gebeurt er indien accidenten de annulus scheuren?
Waarom veroorzaken scheuren in de buitenste annulus lage rugpijn?
Scheuren ontstaan eveneens aan de binnenzijde van de annulus.
Referenties
De annulaire vezelring: wat is dat precies? Even herhalen!
De annulus kan vergeleken worden met een boekje van 15 à 25 bladzijden dat als een cilinder rechtop staat. Elke bladzijde stelt dan een rastervormige lamel voor van de annulus (cf. Blog ‘Lage rugpijn bij jonge mensen. Rol van de kern en de buitenring tot 15 jaar’). Maar er is wel een groot verschil tussen de voor- en achterzijde van deze gelaagde cilinder. De lamellen die vooraan en dichter bij de buikholte liggen, zijn mechanisch veel sterker en stijver dan degene die zich achteraan bevinden1, 2, 3, 4, 5 (Fig. 1). Vandaar dat bulgings en hernia’s vooral voorkomen aan de achterzijde van de discus en zullen uitpuilen in het ruggenmergkanaal.
Tijdens de verouderings- en vooral de degeneratieve processen neemt het aantal lamellen in de annulus af en treden er in hun structuur ook meer defecten op6. In hun collagene vezels ontstaan dan ‘rimpels’, op dezelfde manier als deze zich voordoen in het collageen van onze ouder wordende huid. Maar ouder worden geeft ook in de annulus geen aanleiding tot het ontstaan van pijnlijke letsels of scheuren7, 8. Het verouderingsproces daarentegen is wél verantwoordelijk voor de graduele omvorming van collagene vezels tot littekenweefsel, waardoor de lamellen dikker worden en ook hun plooibaarheid verliezen9, 10, 11.
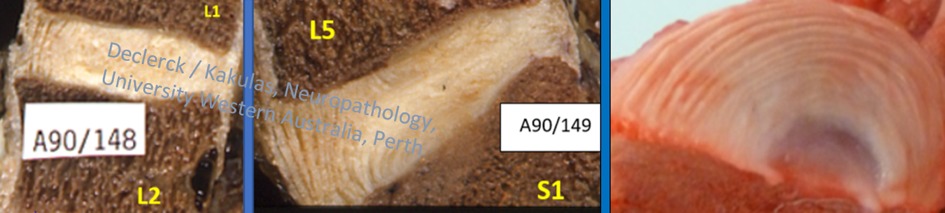
Fig. 1. Links en midden: sagittale secties op de middenlijn doorheen de discus L1-L2 en L5-S1. De annulus is bij de rechtop staande mens vooraan veel sterker gestructureerd (duidelijke verticale lamellen) dan achteraan (doorgaans horizontaler georiënteerd). Rechts: dwarse sectie doorheen de vooraangelegen helft van een discus bij een varken (Sus scrofa domesticus - met dank aan de Dierengezondheidszorg, Flanders, Belgium). De cilindervormige opbouw van de annulaire lamellen is duidelijk zichtbaar (A90/148 en A90/149 - Declerck / Kakulas, Neuropathology, Perth, University Western Australia).
De annulus is, als sterkste mechanische structuur in het lichaam, niet opgewassen tegen de continu belastende verticale krachten
Door zijn geniale mechanische constructie met soms tot 25 naast elkaar liggende rasters, is de annulus de sterkste structuur in het menselijke lichaam. Toch kan de annulus bij de meesten onder ons slechts de eerste twintig levensjaren optimaal blijven functioneren (cf. Blog ‘Lage rugpijn bij jonge mensen. Rol van de kern en de buitenring tot 15 jaar’). Mensen zijn rechtop lopende zoogdieren. Hun discussen blijven continu onderhevig aan onveranderlijke belastende verticale krachten.
De discuskern is het eerste discusonderdeel dat vroegtijdig stijver wordt, wat zijn draagfuncties verstoort. Om de belastende krachten blijvend te kunnen dragen, mag de volledige discus niet te snel als een kaartenhuisje in elkaar storten. Daarom verstevigt de natuur beide andere discusstructuren, met name de annulus en de eindplaten (cf. Blog ‘Degenererende discussen storten als kaarthuisjes in elkaar’). De weerbaarheid van de annulus verhoogt omdat al zijn collageenvezels ook dikker en taaier worden2, 12, 13.
Maar ook de verouderende annulus verliest een groot aantal van zijn collagene vezels en dus ook zijn weerstand tegen die grotere lasten die hij moet helpen dragen. Zijn verminderend aantal lamellen komen steeds meer onder spanning te staan en deze worden van elkaar losgerukt omdat hun fijne verbindende elastische type II-collageenvezeltjes scheuren. Men noemt dat ‘delaminatie’14. Hierdoor wordt de annulus gradueel meer platgedrukt.
Omdat er in de lamellen meer littekenweefsel verschijnt, verliest de verhardende annulus zijn plooibaarheid en ontstaan er steeds meer kleine vermoeidheidsletsels15. Zoals een bal die men wil platpersen, neemt de spanning dan vooral toe aan de buitenzijde van die annulus, waardoor de eerste degeneratieve scheurtjes ook eerst aan de buitenzijde verschijnen16, 17 (Fig. 2). In horizontale rust en wanneer hij minder onderhevig is aan inwerkende verticale lasten, heeft de annulus ook meer moeite zijn normale hoogte te herstellen en blijft hij meer en meer uitpuilen in de richting van het ruggenmergkanaal14. Dit proces wordt dikwijls verkeerdelijk als ‘discushernia’ geïnterpreteerd. Het gebeurt dan ook niet zelden dat iemand met lage rugpijn en slechts op grond van een dergelijke op MRI zichtbare ‘bulging’, compleet ten onrechte op de operatietafel terechtkomt.
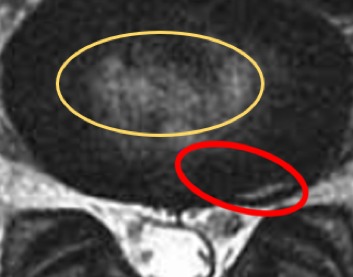
Fig. 2. Afbeelding met toestemming diensthoofd Radiologie in 2017, ASZ, Aalst, België. De eerste degeneratieve scheuren in de annulus ontwikkelen zich ter hoogte van de buitenzijde (rode cirkel). Deze scheuren staan niet in verband met de evoluerende of eventueel aanwezige interne discogene disruptie (IDD) in de kern (gele cirkel) (cf. Blog ‘Verouderende discussen verschillen sterk van degeneratieve discussen. Deel 1 Autopsiegegevens’).
Tijdens autopsies ziet men bijzonder veel annulaire scheuren
Men kan niet anders dan zich bedenkingen maken bij het groot aantal letsels in de annulus die bij quasi iedereen tijdens autopsies van discussen vastgesteld worden. Omdat een scheur zich in de annulus in drie richtingen tegelijk ontwikkelt (verticaal, circulair en radiaal), ziet men tijdens dergelijke autopsies veel meer annulaire scheuren dan op een klassieke MRI18, 19. De reden hiervoor is dat alle klassiek toegepaste radiologische technieken zoals XR, CAT en MRI slechts beelden in twee dimensies (hoogte en breedte) weergeven. Driedimensionele beelden zijn te duur en worden slechts uitgevoerd bij planning van ingewikkelde rugoperaties, zoals corrigerende osteotomies (= ‘doorhakken of doorzagen’ van wervels). Hierdoor worden veel kraakbeenletsels niet vastgesteld20. Als het mogelijk was arthroscopisch onderzoek van de discus uit te voeren (wat niet het geval is, daar er geen gewrichtsholte is), dan zouden exact dezelfde kraakbeenletsels ‘gezien’ kunnen worden als in alle andere gewrichten.
Annulaire scheuren komen voor op alle leeftijden
Deze scheuren, die een gevolg zijn van het falen van de annulaire structuur, kunnen op alle leeftijden voorkomen20, 21, zelfs bij driejarigen22, 23, 24 (cf. Blog ‘Radiologische onderzoeken kunnen de evoluerende letsels in de discus niet in beeld brengen. Het grote belang van wervelzuilautopsieën’). Eenmaal de volwassen skeletleeftijd bereikt, neemt het aantal structurele defecten verder toe6, 12, 23.
Deze annulaire scheuren komen vooral voor ter hoogte van de onderste L4-L5 en L5-S1 discussen25. Ter hoogte van de L1-L2 en L2-L3 discussen vindt men vooral scheuren in de eindplaten25. U kunt hierover meer lezen in een volgende blog.
Annulaire scheuren komen op MRI voor als ‘high intensity zones’
Op alle leeftijden kunnen scheuren in de annulus op MRI zichtbaar worden als ‘high intensity zones’ (= HIZ) (Fig. 3)26. Tenminste wanneer de natuur ze opvult met water of littekenweefsel8, 20. Zo niet blijven ze onzichtbaar.
De meeste van deze kleine zichtbare en onvolledige scheurtjes kunnen nooit met zekerheid verantwoordelijk gesteld worden voor het ontstaan en bestaan van chronische lage rugpijn. Wel worden ze, net als de interne discogene degeneratie (Cf. Blog ‘Verouderende discussen verschillen sterk van degeneratieve discussen. Deel 1: Autopsiegegevens), verantwoordelijk gesteld voor het af en toe optreden van acute opstoten van lage rugpijn20, 27, 28. MRI-beelden van patiënten die helemaal geen lage rugpijn ervaren, vertonen eveneens veel annulaire scheuren29. De verklaring hiervoor kunt u hieronder lezen.
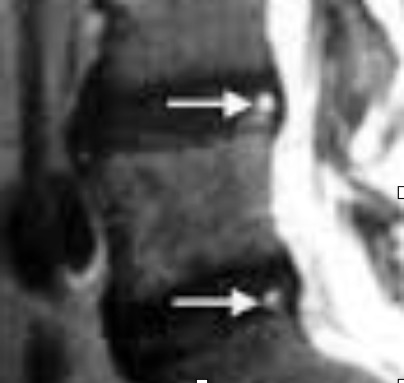
Fig. 3. T2-gewogen MRI-beelden van de lage rug (met toestemming diensthoofd Radiologie in 2002, ASZ, Aalst, België). Beide donkere (en dus verouderende) discussen L4-L5 en L5-S1 vertonen in het achterste en buitenste deel van de annulus een ‘high intensity zone’. Ze kunnen de verklaring zijn voor acute opstoten van lage rugpijn, maar uitermate zelden voor chronische lage rugpijn.
Scheuren in het buitenste deel van annulus kunnen ontstaan zonder tekenen van degeneratie in de kern
Wanneer er scheuren aan de buitenzijde van de annulus voorkomen, wil dit geenszins zeggen dat ook de discuskern zich reeds in een vergevorderd stadium van degeneratie bevindt. Er is dus niet noodzakelijk een verband tussen vastgestelde degeneratieve processen / scheuren aan de buitenzijde van de annulus en die in de kern20, 27, 28, 30, 31 (Fig. 2 en 3).
Noot: degeneratieve radiale scheuren doorheen de volledige annulus ontwikkelen zich wél vanuit een degeneratieve discuskern (zie volgende blog).
Scheuren in het buitenste deel van annulus – ‘outer annular tears’ – ontstaan doorgaans als gevolg van ‘extreme’ bewegingen
Laboratoriumbevindingen stemmen niet overeen met de conclusies van pathologen die beweren dat alle scheuren in de annulus te wijten zijn aan het degeneratieproces23, 32.
(a) Gedurende extreme draaibewegingen kunnen de collagene vezels in de buitenste lamellen van een gezonde annulus scheuren33. Ze worden eerst sterker tegen elkaar aangedrukt vooraleer ze van elkaar losgerukt worden34.
(b) Tijdens het dragen van zware voorwerpen in voorovergebogen houding worden ook complexe belastingskrachten uitgeoefend op gezonde en intacte discussen die aan hun buitenzijde onvolledige scheuren kunnen veroorzaken35. Wanneer deze activiteiten regelmatig gebeuren, kan de annulus volledig scheuren en een discusbulging of zelfs een discushernia vormen36, 37.
(c) Moet men zijn wervelkolom regelmatig overstrekken om bijvoorbeeld zware voorwerpen boven zijn hoofd door te geven of op te stapelen (= hyperextensie) of ondergaat de wervelkolom tijdens een verkeersaccident een plotse voorwaartse beweging (= hyperflexie) (Fig. 4), dan kunnen die grote krachten de annulus aan de buitenzijde scheuren38, 39, 40, 41, 42.
Noot: al deze bewegingen kunnen ook de eindplaten scheuren (cf. volgende blog).
Experimentele scheuren in de buitenste annulus bij dieren initiëren of versnellen wél het degeneratieproces in de kern van de discus
Wanneer men in de annulus van viervoetige zoogdieren zoals konijnen of schapen aan de buitenzijde van de annulus met een naald een kleine prikwonde aanbrengt of een kleine insnede maakt, treden er onomkeerbare degeneratieve processen op in de kern, annulus en eindplaten30, 31, 43, 44, 45.
Anderzijds zal een dergelijk klein letseltje ook de oorzaak zijn van een latere toename van de beweeglijkheid (= flexie en extensie) tussen de twee aanpalende wervels. Men noemt dit segmentale hypermobiliteit, wat compleet verschillend is van ‘mechanische instabiliteit’, dat slechts in laboratoriumomstandigheden kan vastgesteld worden (46). Verklaren dat een patiënt met lage rugpijn een ‘instabiele’ rug heeft, houdt dus geen enkele steek. Hierover meer in een latere blog.
Experimentele scheuren in buitenste annulus genezen niet
Bij deze proefdieren zullen de aangebrachte letsels in de annulus nooit in hun oorspronkelijke toestand genezen. Er is wél een perfect herstel mogelijk door de vorming van kraakbenig littekenweefsel47 waarin enkele bloedvaatjes kunnen ingroeien43, 47, 48, 49. Dit herstelweefsel noemt men dan ‘granulatieweefsel’. Tijdens deze analyses stelde men ook in de discuskern geen enkele genezing vast, zelfs niet wanneer de wervels boven en onder de annulaire letsels aan elkaar werden vastgemaakt met plaat en vijzen43, 44, 45.
Er groeien ook pijngevoelige zenuwvezeltjes in!
Normalerwijze bevinden zich aan de buitenzijde van de annulus eindtakken van niet-pijngevoelige zenuwtjes. Ze groeien niet verder door tot in de buitenste 3 mm van de annulus50, 51, 64, 65. In de vermelde experimentele annulaire scheuren kunnen ook pijngevoelige zenuwtjes ingroeien43, 44, 45, 47, 52.
Hoe evolueren de buitenste scheuren in de annulus van de mens?
Scheuren in het buitenste deel van de annulus leiden onherroepelijk tot volledige degeneratie van de discuskern53, 54, 55. Zowel de collagene vezels die zorgen voor de elasticiteit als de suikereiwitten die instaan voor het aantrekken van water, worden afgebroken. Hierdoor kan door de kern steeds minder weerstand geboden worden aan de samendrukkende verticale krachten en vergroot de belasting op de annulus. Ook de beweeglijkheid tussen de aanpalende wervels wordt verstoord48, 55, 56, 57, 58, 59.
Omdat de discus geen bloedvoorziening en veel te weinig cellen60a, 60b heeft, beschikt hij over geen enkele mogelijkheid om zijn suikereiwitten en collagene vezels te remodelleren en opnieuw aan te maken61. De natuur zorgt ervoor dat de collagene vezels in de annulus steeds dikker en taaier worden48. Het finale resultaat is dat de prachtige initiële structuur van de discus omgevormd wordt tot een massa littekenweefsel. Deze vaststelling kan mogelijks leiden tot de ontwikkeling van een innovatieve en oorzakelijke behandeling.
Wat gebeurt er indien accidenten de annulus scheuren?
Verkeersaccidenten kunnen annulaire letsels veroorzaken (Fig. 4). Omdat hierdoor de discuskern nog sneller water verliest, zal de discus nog sneller degenereren62. Zo vertonen adolescenten die door een ongeval hun eindplaten scheuren, binnen de 4 jaar degeneratieve letsels in hun discus63.
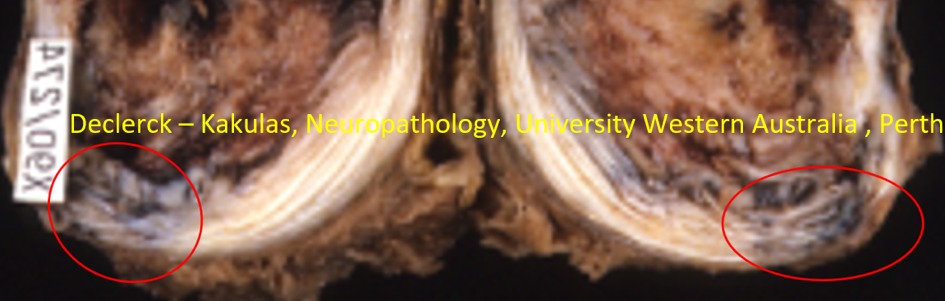
Fig. 4. Als gevolg van een verkeersaccident met fatale afloop scheurde de annulus van de L1-L2 discus ter hoogte van de posterolaterale hoek waar reeds door veroudering en degeneratie veel minder lamellen aanwezig zijn. In de ruimten tussen de gescheurde lamellen ziet men opstapeling van bloed (= soort ‘blauwe plek’). De vooraangelegen lamellen (witte zone) vertonen heel duidelijk de door littekenweefsel versterkte lamellen (X90/574 – M, 78 - Declerck / Kakulas, Neuropathology, University Western Australia, Perth).
Waarom veroorzaken scheuren in de buitenste annulus lage rugpijn?
In de drie buitenste lamellen van de normale annulus bevinden zich zenuwuiteinden50, 51, 64, 65. Deze mechanoreceptoren (= Ruffini, Pacini, Golgi en vrije zenuwuiteinden) informeren onze hersenen over de positie die de wervelkolom inneemt en over de aard van de bewegingen die ze uitvoert. Wanneer de annulus mechanisch belast en gestresseerd wordt (cf. Blog ‘Functies van discussen in de lage rug’), zullen deze vier types mechanoreceptoren de activiteiten van rugspieren aanpassen om de wervelkolom te beschermen tegen overdreven bewegingen66, 67, 68, 69.
In tegenstelling tot de normale discus groeien er tijdens het herstel van de scheuren aan de buitenzijde van de annulus pijngevoelige zenuwvezeltjes doorheen het littekenweefsel43, 44, 45, 47, 52. Wanneer de discus dan veel te sterk belast wordt, vormen de hoogste concentraties aan mechanische stress zich ook ter hoogte van de achterzijde van de annulus waar de meeste scheuren zullen voorkomen. Personen bij wie veel meer pijngevoelige mechanoreceptoren in de annulus ingroeiden, kunnen dan lage rugpijn ervaren62, 70. Hun annulus stuurt meer pijnsignalen naar hun hersenen door die aldaar als opstoten van lage rugpijn herkend worden64.
Scheuren ontstaan eveneens aan de binnenzijde van de annulus
Wanneer men bij overleden twintigjarigen discussen van de lage rug met bariumsulfaatkleurstof (BaSO4) injecteert (= discografie), bemerkt men dat reeds 2 op 3 discussen scheuren vertonen ter hoogte van de binnenste lamellen van de annulus20. Voor zover ik weet, zijn ze moeilijk waar te nemen op MRI-beelden.
Onderwerpt men in laboratoria oudere wervelkolommen met reeds aanwezige degeneratieve discuskernen (= IDD) aan toenemende draaibewegingen, dan zullen er ook eerst aan de binnenzijde scheuren ontstaan vooraleer deze zich radiaal doorheen de volledige annulus naar de buitenzijde van de discus kunnen uitbreiden (cf. volgende blog). Het is moeilijk aan te nemen dat deze ‘binnenste’ scheuren lage rugpijn kunnen opwekken omdat daar geen pijngevoelige zenuwvezeltjes voorkomen. Wanneer de discus aan zijn buitenzijde niet gescheurd is, blijft de deur toe voor zenuwen die zich aan de buitenzijde bevinden.
De volgende blog bespreekt de evoluerende degeneratieve scheuren die doorheen de volledige annulus lopen. Deze radiale scheuren kunnen ernstige pijn veroorzaken in de lage rug maar veel minder in het onderbeen.
Referenties
- Skaggs DL, Weidenbaum M, Iatridis JC et al., ‘Regional variation in tensile properties and biochemical composition of the human lumbar anulus fibrosus’,
Spine, 1994, 19:1310
- Ebara S, Iatridis JC, Setton LA et al., ‘Tensile properties of nondegenerate human lumbar anulus fibrosus’,
Spine, 1996, 21:452
- Elliott DM, Setton LA, ‘Anisotropic and inhomogeneous tensile behavior of the human anulus fibrosus. Experimental measurement and material model predictions’,
J Biomech Eng, 2001, 123:256
- Holzapfel GA, Schulze-Bauer CA, Feigl G et al., ‚ Single lamellar mechanics of the human lumbar anulus fibrosus’,
Biomech Model Mechanobiol, 2005, 3:125
- Shan Z, Li S, Liu J et al., ‘Correlation between biomechanical properties of the annulus fibrosus and magnetic resonance imaging (MRI) findings’,
Eur Spine J, 2015, 24:1909
- Bernick S, Walker JM, Paule WJ, ‘Age changes to the anulus fibrosus in human intervertebral discs’,
Spine, 1991, 16:520
- Videman T, Nurminen M, Troup JD, ‘Lumbar spinal pathology in cadaveric material in relation to history of back pain, occupation, and physical loading. 1990 Volvo Award in clinical sciences’,
Spine, 1990, 15:728
- Moneta GB, Videman T, Kaivanto K et al., ‘Reported pain during lumbar discography as a function of anular ruptures and disc degeneration. A re-analysis of 833 discograms’,
Spine, 1994, 19:1968
- Markolf KL, Morris JM, ‘The structural components of the intervertebral disc. A study of their contributions to the ability of the disc to withstand compressive forces’,
J Bone Joint Surg, 1974, 56A:675
- Brinckmann P, Grootenboer H, ‘Change of disc height, radial disc bulge, and intradiscal pressure from discectomy. An in vitro investigation on human lumbar discs’,
Spine, 1991, 16:641
- Adams M, Bogduk N, Burton K, Dolan P, ‘The biomechanics of back pain. Second edition’,
Churchill Livingstone, Edinburgh, Elsevier, 2006: plate 1
- Marchand F, Ahmed AM, ‘Investigation of the laminate structure of lumbar disc anulus fibrosus’,
Spine, 1990, 15:402
- Acaroglu ER, Iatridis JC, Setton LA et al., ‘Degeneration and aging affect the tensile behavior of human lumbar anulus fibrosus’,
Spine, 1995, 20:2690
- Vernon-Roberts B, Fazzalari NL, Manthey BA, ‘Pathogenesis of tears of the anulus investigated by multiple-level transaxial analysis of T12-L1 disc’,
Spine, 1997, 22:2641
- Adams MA, Bogduk N, Burton K, Dolan P, ‘Damage, injury and fatigue failure’,
In ‘The biomechanics of back pain. Third edition’, Edinburgh, Churchill Livingstone, Elsevier, 2013:138
- Vernon-Roberts B, Pitie CJ, ‘Degenerative changes in the intervertebral discs of the lumbar spine and their sequelae’,
Rheumatol Rehab, 1977, 16:13
- Adams MA, Roughley PJ, ‘What is intervertebral disc degeneration, and what causes it?’
Spine, 2006, 31:2151
- Osti OL, Fraser RD, ‘MRI and discography of annular tears and intervertebral disc degeneration. A prospective clinical comparison’,
J Bone Joint Surg, 1992, 74B:431
- Kakitsubata Y, Theodorou DJ, Theodorou SJ et al., ‘Magnetic resonance discography in cadavers. Tears of the annulus fibrosus’,
Clin Orthop Relat Res, 2003, 407:228
- Videman T, Nurminen M, ‘The occurrence of anular tears and their relation to lifetime back pain history. A cadaveric study using barium sulfate discography’,
Spine, 2004, 29:2668
- Boos N, Weissbach S, Rohrbach H et al., ‘Classification of age-related changes in lumbar intervertebral discs. 2002 Volvo Award in basic science’,
Spine, 2002, 27:2631
- Kjaer P, Leboeuf-Yde C, Sorensen JS et al., ‘An epidemiologic study of MRI and low back pain in 13-year-old children’,
Spine, 2005, 30:798
- Haefeli M, Klaberer F, Saegesser D et al., ‘The course of macroscopic degeneration in the human lumbar intervertebral disc’,
Spine, 2006, 31:1522
- Adams MA, Bogduk N, Burton K, Dolan P, ‘The biomechanics of back pain. Third edition’,
Edinburgh, Churchill Livingstone, Elsevier, 2013:90
- Adams MA, Dolan P, ‘Intervertebral disc degeneration. Evidence for two distinct phenotypes’,
J Anat, 2012, 221:497
- www.guy-declerck.com / Degenerative Discogenic Syndrome / Disc radiology, CAT and MRI
- Videman T, Battié MC, Gibbons LE et al., ‘Associations between back pain history and lumbar MRI findings’,
Spine, 2003, 28:582
- Carragee EJ, Paragioudakis SJ, Khurana S, ‘Lumbar high-intensity zone and discography in subjects without low back problems. 2000 Volvo Award winner in clinical studies’,
Spine, 2000, 25:2987
- Weishaupt D, Zanetti M, Hodler J et al., ‘MR imaging of the lumbar spine. Prevalence of intervertebral disk extrusion and sequestration, nerve root compression, end plate abnormalities, and osteoarthritis of the facet joints in asymptomatic volunteers’,
Radiology, 1998, 209:661
- Hsieh AH, Hwang D, Ryan DA et al., ‚ ’Degenerative anular changes induced by puncture are associated with insufficiency of disc biomechanical function’,
Spine, 2009, 34:998
- Elliott DM, Yerramalli CS, Beckstein JC et al., ‘The effect of relative needle diameter in puncture and sham injection animal models of degeneration’,
Spine, 2008, 33:588
- Vernon-Roberts B, Moore RJ, Fraser RD, ‘The natural history of age-related disc degeneration. The pathology and sequelae of tears’,
Spine, 2007, 32:2797
- Adams MA, Hutton WC, ‘The relevance of torsion to the mechanical derangement of the lumbar spine’,
Spine, 1981, 6:241
- Farfan HF, Cossette JW, Robertson GH et al., ‘The effects of torsion on the lumbar intervertebral joints. The role of torsion in the production of disc degeneration’,
J Bone Joint Surg, 1970, 52A:468
- Adams MA, Hutton WC, ‘The effect of fatigue on the lumbar intervertebral disc’,
J Bone Joint Surg, 1983, 65:199
- Adams MA, Hutton WC, ‘Prolapsed intervertebral disc. A hyperflexion injury 1981 Volvo Award in Basic Science’,
Spine, 1982, 7:184
- Adams MA, Hutton WC, ‘Gradual disc prolapse’,
Spine, 1985, 10:524
- Lippitt AB, ‘Fracture of a vertebral body end plate and disk protrusion causing subarachnoid block in an adolescent’,
Clin Orthop Relat Res, 1976, 116:112
- Techakapuch S, ‘Rupture of the lumbar cartilage plate into the spinal canal in an adolescent. A case report’,
J Bone Joint Surg, 1981, 63A:481
- Granhed H, Morelli B, ‘Low back pain among retired wrestlers and heavyweight lifters’,
Amer J Sports Med, 1988,16:530
- Hsu KY, Zucherman JF, Derby R et al., ‘Painful lumbar end-plate disruptions. A significant discographic finding’,
Spine, 1988, 13:76
- McFadden KD, Taylor JR, ‘End-plate lesions of the lumbar spine’,
Spine, 1989, 14:867
- 43. Osti OL, Vernon-Roberts B, Fraser RD, ‘Anulus tears and intervertebral disc degeneration. An experimental study using an animal model. 1990 Volvo Award in experimental studies’,
Spine, 1990, 15:762
- Moore RJ, Osti OL, Vernon-Roberts B et al., ‘Changes in endplate vascularity after an outer anulus tear in the sheep’,
Spine, 1992, 17:874
- Moore RJ, Latham JM, Vernon-Roberts B et al., ‘Does plate fixation prevent disc degeneration after a lateral anulus tear?’,
Spine, 1994, 19:2787
- White AA III, Panjabi MM, ‘Clinical biomechanics of the spine. Second edition. The problem of clinical instability in the human spine: a systematic approach. Part 4: the lumbar and lumbosacral spine’,
J.B. Lippincott Company, Philadelphia, 1990:342-361
- 47. Melrose J, Roberts S, Smith S et al., ‘Increased nerve and blood vessel ingrowth associated with proteoglycan depletion in an ovine anular lesion model of experimental disc degeneration’,
Spine, 2002, 27:1278
- Hampton D, Laros G, McCarron R et al., ‘Healing potential of the anulus fibrosus’,
Spine, 1989, 14:398
- Kääpa E, Han X, Holm S et al., ‘Collagen synthesis and types I, III, IV, and VI collagens in an animal model of disc degeneration’
Spine, 1995, 20:59
- Palmgren T, Grönblad M, Virri J et al., ‘An immunohistochemical study of nerve structures in the anulus fibrosus of human normal lumbar intervertebral discs’,
Spine, 1999, 24:2075
- Dimitroulias A, Tsonidis C, Natsis K et al., ‘An immunohistochemical study of mechanoreceptors in lumbar spine intervertebral discs’,
J Clin Neurosci, 2010, 17:742
- Latham JM, Pearcy MJ, Costi JJ et al., ‘Mechanical consequences of annular tears and subsequent intervertebral disc degeneration’,
Clin Biomech, 1994, 9:211
- Farfan HF, ‘Mechanical disorders of the low back’,
London, Henry Kimpton, 1973
- Adams MA, Bogduk N, Burton K, Dolan P, ‘The biomechanics of back pain. Third edition’,
Churchill Livingstone, Elsevier, 2013:199
- Melrose J, Ghosh P, Taylor TK et al., ‘A longitudinal study of the matrix changes induced in the intervertebral disc by surgical damage to the annulus fibrosus’,
J Orthop Res, 1992, 10:665
- 56. Ahlgren BD, Vasavada A, Brower RS, ‘Anular incision technique on the strength and multidirectional flexibility of the healing intervertebral disc’,
Spine, 1994, 19:948
- Ethier DB, Cain JE, Yaszemski MJ et al., ‘The influence of anulotomy selection on disc competence. A radiographic, biomechanical, and histologic analysis’,
Spine, 1994, 19:2071
- Mochida J, Nishimura K, Nomura T et al., ‘The importance of preserving disc structure in surgical approaches to lumbar disc herniation’,
Spine, 1996, 21:1556
- Carragee EJ, Spinnickie AO, Alamin TF et al., ‘A prospective controlled study of limited versus subtotal posterior discectomy. Short-term outcomes in patients with herniated lumbar intervertebral discs and large posterior anular defect’,
Spine, 2006 31:653
60a. Hastreiter D, Ozuna RM, Spector M, ‘Regional variations in certain cellular characteristics in human lumbar intervertebral discs, including the presence of alpha-smooth muscle actin’,
J Orthop Res, 2001, 19:597
60b. Vernon-Roberts B, Moore, RJ, Fraser RD, ‘The natural history of age-related disc degeneration: the influence of age and pathology on cell populations in the L4-L5 disc’,
Spine, 2008, 33:2767
- Adams MA, Bogduk N, Burton K, Dolan P, ‘The biomechanics of back pain’, Third edition’,
Churchill Livingstone, Elsevier, 2013:85
- Osti OL, Vernon-Roberts B, Moore R et al., ‘Annular tears and disc degeneration in the lumbar spine. A post-mortem study of 135 discs’,
J Bone Joint Surg, 1992, 74B:678
- Kerttula LI, Serlo WS, Tervonen OA et al., ‘Post-traumatic findings of the spine after earlier vertebral fracture in young patients. Clinical and MRI study’,
Spine, 2000, 25:1104
- 64. Roberts S, Eisenstein SM, Menage J et al., ’Mechanoreceptors in intervertebral discs. Morphology, distribution, and neuropeptides’,
Spine, 1995, 20:2645
- Dimitroulias A, Tsonidis C, Natsis K et al., ‘An immunohistochemical study of mechanoreceptors in lumbar spine intervertebral discs’,
J Clin Neurosci, 2010, 17:742
- Freeman MA, Wyke B, ‘The innervation of the knee joint. An anatomical and histological study in the cat’,
J Anat, 1967, 101:505
- Zimny ML, ‘Mechanoreceptors in articular tissues’,
Am J Anat, 1988, 182:16
- Schutte MJ, Happel LT, ‘Joint innervation in joint injury’,
Clin Sports Med, 1990, 9:511
- Johansson H, Sjölander P, Sojka P, ‘Receptors in the knee joint ligaments and their role in the biomechanics of the joint’,
Crit Rev Biomed Eng, 1991, 18:341
- Olmarker K, ‘Puncture of a lumbar intervertebral disc induces changes in spontaneous pain behavior. An experimental study in rats’,
Spine, 2008, 33:850
* Guy Declerck, MD
- 1964, Grieks-Latijnse Humaniora
- 1978, Dokter in de Genees-,Heel-, en Verloskunde (KUL)
- 1983, Medische Specialist in de Orthopedie (KUL & Exeter, UK)
- 1988, Postgraduate Orthopedic Surgery (Plymouth & Liverpool, UK)
- 1989, Spinal Fellow in Adult Spinal Surgery (Perth, Australia)
- 1989, Research Fellow in Spinal Injuries & Rehabilitation (Perth, Australia)
- 1989, Neuromuscular Foundation of Western Australia Postgraduate Studentship
- 1992, Spinaal Orthopedisch Chirurg (Vlaanderen en buitenland)
- 1992, Medical Doctor National Belgian Judo Team
- 1993, European Spine Research Fellowship ‘Bionic Walking’ (Stoke-on-Trent, UK)
- 1994, Worldwide Encyclopaedia Invited Surgeon and SAFIR Spinal Travel Fellowship
- 2003, Rugchirurg-op-rust in Vlaanderen
- 2003-2006, Sabbatical
- 2007-2014, International Spinal Research, Spinal Scientific Advisory Consultant & Instructor
- 2007-now, Consultant Research & Development Innovative & Restorative Spinal Technologies
- 2007-now, Spinal Lecturing & Writing, Surgical Education (www.guy-declerck.com en www.hhp.be/nl/blog)
- 2012-now: President International Association Andullation Therapy (www.iaat.eu/Science)