Que se passe-t-il quand une articulation synoviale souffre d’« arthrose » ?
Index
- Introduction
- Aucune « arthrose » ne peut se développer dans une articulation qui n’a pas de muqueuse, comme le disque intervertébral
- Grande différence entre « arthrose » du dos et « arthrose » des bras et jambes
- Pourquoi est-ce que l’arthrose se développe dans une articulation ?
- Qu’en est-il des fibrilles de collagène de type II ?
- Quelle est la fonction des cellules de cartilage dans une articulation ?
- Que se passe-t-il quand la qualité du cartilage se détériore ?
- Le cartilage se fragilise progressivement
- Quelles sont les formes les plus graves d’« arthrose » ?
- L’« arthrose », une affection irréversible et incurable
- Les articulations doivent rester en mouvement pour bien fonctionner
- On devrait pouvoir réparer ou changer un cartilage articulaire usé
- Références
Introduction
Afin de développer des traitements efficaces, l’on doit d’abord savoir précisément ce qu’il se passe lorsque de l’« arthrose » se développe dans une articulation. L’« arthrose » ne touche alors pas seulement la muqueuse, le liquide synovial et le cartilage (hyalin) de l’articulation usée, mais également les os environnants. L’appellation « arthrose » n’est pas une dénomination correcte pour ce type d’affection articulaire. Étant donné qu’elle s’accompagne d’un processus inflammatoire stérile, le terme « ostéoarthrite » est plus adapté.
Aucune « arthrose » ne peut se développer dans une articulation qui n’a pas de muqueuse, comme le disque intervertébral
Les mécanismes de mouvement dans les articulations avec muqueuse — ce que l’on appelle les articulations synoviales — telles que l’épaule, le coude, le poignet, la hanche, le genou, la cheville ou les petites articulations des mains et pieds, sont bien plus simples que celles de la colonne vertébrale. Le disque intervertébral n’a en effet pas de muqueuse. Les mouvements du dos sont bien plus complexes. Avant tout, il faut, dans le dos, une coordination parfaite entre disques intervertébraux sans muqueuse et les articulations facettaires qui en possèdent.
Grande différence entre « arthrose » du dos et « arthrose » des bras et jambes
Des problèmes des suites d’une « arthrose du dos » ne peuvent en aucun cas être comparés avec l’« arthrose » dans les articulations synoviales des bras et jambes (voir article « Arthrose des bras et des jambes : ce que nous devrions tous savoir »). Les douleurs dorsales sont très rarement dues à une « arthrose facettaire »1. Dans les cas où l’arthrose facettaire est diagnostiquée par imagerie radio, le disque intervertébral est déjà dans un état de détérioration avancé (dans les articles à venir, nous aborderons la dégénérescence du disque plus en détail). On peut rarement parler d’« arthrose facettaire » dans le dos. Le terme « arthrose discale » est une contradiction, car le disque ne comporte pas de muqueuse. Les inflammations discales apparaissent donc pour de tout autres raisons. Nous aborderons ces phénomènes dans nos prochains articles.

Pourquoi est-ce que l’arthrose se développe dans une articulation ?
L’« arthrose » touche une articulation quand la matière dont elle se compose s’use et se détériore. C’est comparable à une maison sur pilotis au milieu d’une mer, dont les piliers se rapprochent progressivement vers le milieu, jusqu’à ce que la maison coule. Dans les articulations possédant une muqueuse, comme les articulations synoviales susmentionnées, les piliers se composent presque exclusivement de fibres collagènes de type II. Celles-ci sont comme de solides tiges de bambou. Ces « tiges » de collagène qui composent le cartilage possèdent une structure tridimensionnelle complexe, mais ont par ailleurs suffisamment d’espace pour abriter les cellules de cartilage (Fig. 1)
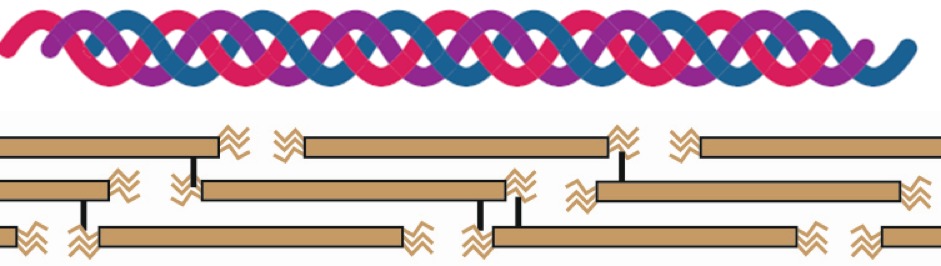
Fig. 1. Plusieurs fibrilles de collagène sont attachées afin de former une fibre de collagène selon un plan bien précis et défini génétiquement. Les fibres de collagène diffèrent d’un individu à l’autre. La partie supérieure de cette illustration représente une fibre de collagène. Elle se compose de trois fibrilles (représentés par les lignes rouge, bleue et violette) qui s’entrelacent sur un plan tridimensionnel. La partie inférieure de l’illustration représente les liaisons chimiques qui relient les fibrilles de collagène entre elles (liaisons croisées). Il reste entre ces fibrilles assez de place pour les cellules de cartilage.
Qu’en est-il des fibrilles de collagène de type II ?
Lorsque les liaisons croisées se détériorent à cause de l’usure, les fibrilles de collagène se retrouvent de plus en plus compressées. Les fibres de collagène vont alors devenir plus fines et fragiles, assumant de plus en plus difficilement leur rôle de soutien 2,3. En découle une réduction de l’espace pour les cellules de cartilage. Elles ne diminuent pas seulement en nombre, mais elles s’autodétruisent (= apoptose) et finissent par mourir (= nécrose) 4. Les cellules vivantes se regroupent (= » clusters »), mais disposent alors de trop peu d’espace pour pouvoir fonctionner correctement5,6.
Quelle est la fonction des cellules de cartilage dans une articulation ?
Dans des conditions normales, les cellules de cartilage sont responsables de la formation des fibrilles de collagène, mais également des importants protéoglycanes. Il s’agit de glucides accrochés à des protéines. Pour faire simple, je les appelle les « glucides protéiques ». Lorsque moins de ces glucides protéiques sont produits, le cartilage est moins capable d’absorber et conserver l’eau. Conséquence : le cartilage est moins résistant, moins élastique, et est donc moins à même de résister aux charges et aux forces mécaniques du quotidien. Les cellules du cartilage qui sentent leur fin approcher prennent pour ainsi dire des mesures désespérées. Elles réagissent contrairement à leur objectif initial : elles libèrent des enzymes qui décomposent leurs propres fibrilles de cartilage. Comme à la guerre, où le vaincu fait sauter son quartier général dans un dernier geste de désespoir.
Les principales enzymes destructrices s’appellent les métalloprotéases matricielles (MMP). Les cellules de cartilage ne veulent rien laisser de leur quartier général après leur mort ! Les produits de la dégradation, tels que l’acide hyaluronique, le sulfate de kératine ou le sulfate de chondroïtine se retrouvent dans le liquide synovial et la muqueuse de l’articulation. Et comme si cela ne suffisait pas, le reste des cellules de cartilage vivantes ne produit pas seulement des protéines inflammatoires (cytokines pro-inflammatoires), mais également des substances qui perturbent le système immunitaire7,8,9,10,11.
L’illustration parfaite de l’expression « douce vengeance ».
Que se passe-t-il quand la qualité du cartilage se détériore ?
Un cartilage normal doit pouvoir résister aux pressions, tractions et tensions des activités du quotidien. En temps normal, la muqueuse de l’articulation et le liquide synovial contiennent les protéines nécessaires (=complexes hyaluronate et glycoprotéines) afin de garantir l’apport en nutriments et la lubrification nécessaires. Lorsque cela accroît le nombre de produits de dégradation du cartilage qui finissent dans la muqueuse et le liquide synovial, la lubrification s’avère bien moins efficace12,13,14,15,16.
Le cartilage se fragilise progressivement
Le cartilage devient de plus en plus fragile. Il résiste alors de plus en plus difficilement aux diverses charges mécaniques et s’expose alors à une dégradation. Un nombre toujours croissant de cellules de cartilage meurt, et la dégradation des « glucides protéiques » s’intensifie, alors que l’os sous la couche de cartilage fait face à des attaques de plus en plus nombreuses17,18,19,20,21,22. Le cartilage affiche alors de plus en plus de petites lésions et déchirures, ce qui envoie des petits morceaux de cartilage dans le liquide synovial. Ces morceaux y trouvent des nutriments en grande quantité et finissent par se transformer en souris articulaire. De la même façon qu’une charnière de porte peut être bloquée par un objet étranger, ces « souris » de cartilage peuvent entraîner le blocage d’une articulation.
Qu’en est-il des formes graves d’« arthrose » ?
Dans les cas plus sévères d’arthrose, la détérioration de certaines parties de l’articulation est tellement avancée que le cartilage est complètement détruit23,24. Parfois cela entraine la présence de cicatrices du cartilage. Ce tissu fibrocartilagineux n’est en aucun cas capable de supporter des charges et finit, lui aussi, par se faire ronger. La situation se dégrade encore davantage lorsque les os se frottent l’un à l’autre : os contre os 25,26.
Étant donné que les os possèdent de nombreux nerfs, la douleur a tôt fait de se propager. Les structures articulaires environnantes, telles que la capsule articulaire et les muscles, sont également atteintes par ce processus dégénératif.

L’« arthrose », une affection irréversible et incurable
Le processus de détérioration évolue pendant de nombreuses années. Le problème, c’est que l’« arthrose » se développe discrètement, sans se faire remarquer. On ne sent pas que l’articulation s’use… jusqu’à ce qu’il soit trop tard. C’est néanmoins sans grande importance. Même si on pouvait sentir l’« arthrose » dès son apparition, cela n’entraverait pas le processus de détérioration. Étant donné que le cartilage est dépourvu de vaisseaux sanguins, l’autoguérison n’est absolument pas possible. L’« arthrose » reste donc à ce jour un phénomène irréversible et incurable, qui progresse inlassablement.
Les articulations doivent continuer à bouger pour fonctionner correctement
« Le repos fait rouiller ». Afin de continuer à fonctionner, les articulations doivent rester soumises quotidiennement à des mouvements, des charges mécaniques et des stimuli. Même lorsque les mouvements sont rendus difficiles par la douleur, les cellules de cartilage restantes, aussi peu nombreuses soient-elles, peuvent être stimulées via des vibrations mécaniques14,27,28. La stimulation par vibration est de grande importante pour maintenir la capacité de régénération des cellules de cartilage adultes restantes27. Ceci n’est pas si difficile à comprendre. Comme chaque cellule, ces cellules cartilagineuses possèdent des mécanorécepteurs qui détectent les signaux vibratoires. Les cellules sont alors incitées à produire plus de fibrilles de cartilage et moins d’enzymes destructrices (MMP)27,28,29.
On devrait pouvoir réparer ou changer le cartilage articulaire usé
‘Indien meneer ZOU had geleefd, had ik veel meer gepresteerd’, zei mijn moeder zaliger vaak. Met muizen, ratten en konijnen bereikt men in een laboratorium en na intensieve research soms veelbelovende resultaten. Maar na publicatie van deze dierexperimenten wordt zelden nog spectaculaire vooruitgang geboekt. Bij de mens bereikt men af en toe ‘iets’ dat min of meer vergelijkbaar is met de goede ‘muisresultaten’. In laboratoriumomstandigheden kan men proefdieren uren laten bewegen, massa’s pillen laten slikken, diverse injecties geven (medicatie, hyaluronzuur, chondroitine, glutamine etc.), kraakbeentransplantaties uitvoeren, stamcellen inplanten etc. Maar de mens is een speciaal zoogdier dat sterk verschilt van een muis, rat of konijn. Men vliegt naar de maan. In 2015 kon men op 1.500.000.000 lichtjaren van de aarde twee zwarte gaten tegen elkaar horen botsen. En binnenkort kan ik wellicht mee naar Mars. Maar er is nog een heel lange weg te gaan vooraleer men het wondermiddel zal ontdekken dat een versleten artrotisch gewricht kan herstellen.
On arrive de temps à autre à des découvertes en ayant recourt à des souris, rats et lapins en laboratoire. Néanmoins, une fois les résultats publiés, cela entraine rarement des avancées notables. Chez l’homme, on découvre parfois « quelque chose » de comparable aux résultats sur les rongeurs. En conditions de laboratoire, on peut manipuler des animaux, leur donner tout un tas de pilules, diverses injections (médicaments, acide hyaluronique, sulfate de chondroïtine, glutamine, etc.), des greffes de cartilage, des cellules souches, etc. L’Homme est cependant un mammifère bien particulier, qui diffère grandement des souris, rats ou lapins. On est allés sur la Lune. En 2015, on a pu entendre deux trous noirs s’entredévorer à 1 500 000 000 années-lumière de la Terre. Peut-être même qu’un jour j’irai sur Mars. La route est néanmoins encore longue avant que l’on découvre le remède miracle pour guérir les articulations usées.
Dans le prochain article, je donnerai un mot d’explication sur les traitements disponibles pour l'arthrose.
Références
1 www.guy-declerck.com / Spinal Pathologies / Lumbar Facet Syndrome
2 Valli M, Leonardi L, Strocchi R et al., ‘“In vitro” fibril formation of type I collagen from different sources. Biochemical and morphological aspects’, Connect Tissue Res, 1986, 15:235
3 Reihsner R, Menzel EJ, ‘Two-dimensional stress-relaxation behavior of human skin as influenced by non-enzymatic glycation and the inhibitory agent aminoguanidine’, J Biomech, 1998, 31:985
4 Tran-Khan N, Hoemann CD, McKee MD et al., ‘Aged bovine chondrocytes display a diminished capacity to produce a collagen-rich, mechanically functional cartilage extracellular matrix’, J Orthop Res, 2005, 23:1354
5 Bank RA, Bayliss MT, Lafeber FP et al., ‘Ageing and zonal variation in post-translational modification of collagen in normal human articular cartilage. The age-related increase in non-enzymatic glycation affects biomechanical properties of cartilage’, Biochem J, 1998, 330:345
6 DeGroot J, Verzijl N, Bank RA et al., ‘Age-related decrease in proteoglycan synthesis of human articular chondrocytes. The role of nonenzymatic glycation’, Arthritis Rheum, 1999, 42:1003
7 Price JS, Waters JG, Darrah C et al., ‘The role of chondrocyte senescence in osteoarthritis’, Aging Cell, 2002, 1:57
8 Martin JA, Brown T, Heiner A et al., ‘Post-traumatic osteoarthritis. The role of accelerated chondrocyte senescence’, Biorheology, 2004, 41:479
9 Philipot D, Guérit D, Patano D et al., ‘p16INK4a and its regulator miR-24 link senescence and chondrocyte terminal differentiation-associated matrix remodeling in osteoarthritis’, Arthritis Res Ther, 2014, 16:R58
10 Glyn-Jones S, Palmer AJR, Agricola R et al., ‘Osteoarthritis’, Lancet, 2015, 386:376
11 McCulloch K, Litherland GJ, Rai TS, ‘Cellular senescence in osteoarthritis pathology’, Aging Cell, 2017, 16:210
12 Loeser RF Jr, ‘Aging cartilage and osteoarthritis--what's the link?’, Sci Aging Knowledge Environ, 2004, 2004:pe31
13 Setton LA, Chen J, ‘Cell mechanics and mechanobiology in the intervertebral disc’, Spine, 2004, 29:2710
14 Guilak F, Fermor B, Keefe FJ et al., ‘The role of biomechanics and inflammation in cartilage injury and repair’, Clin Orthop Relat Res, 2004, 423:17
15 Loeser RF, ‘Molecular mechanisms of cartilage destruction. Mechanics, inflammatory mediators, and aging collide’, Arthritis Rheum, 2006, 54:1357
16 Rutjes AW, Jüni P, da Costa BR et al., ‘Viscosupplementation for osteoarthritis of the knee. A systematic review and meta-analysis’, Ann Intern Med, 2012, 157:180
17 Yao JQ, Seedhom BB, ‘Mechanical conditioning of articular cartilage to prevalent stresses’, Br J Rheumatol, 1993, 32:956
18 Adams MA, Kerin AJ, Wisnom MR, ‘Sustained loading increases the compressive strength of articular cartilage’, Connect Tissue Res, 1998, 39:245
19 Clements KM, Bee ZC, Crossingham GV et al., ‘How severe must repetitive loading be to kill chondrocytes in articular cartilage?’, Osteoarthritis Cartilage, 2001, 9:499
20 Kerin AJ, Coleman A, Wisnom MR et al., ‘Propagation of surface fissures in articular cartilage in response to cyclic loading in vitro’Clin Biomech, 2003, 18:960
21 Rogers BA, Murphy CL, Cannon SR et al., ‘Topographical variation in glycosaminoglycan content in human articular cartilage’, J Bone Joint Surg, 2006, 88B:1670
22 Huser CA, Davies ME, ‘Validation of an in vitro single-impact load model of the initiation of osteoarthritis-like changes in articular cartilage’, J Orthop Res, 2006, 24:725
23 Verzijl N, DeGroot J, Thorpe SR et al., ‘Effect of collagen turnover on the accumulation of advanced glycation end products’, J Biol Chem, 2000, 275:39027
24 DeGroot J, Verzijl N, Wenting-van Wijk MJ et al., ‘Accumulation of advanced glycation end products as a molecular mechanism for aging as a risk factor in osteoarthritis’, Arthritis Rheum, 2004, 50:1207
25 Lawrence RC, Helmick CG, Arnett FC et al., ‘Estimates of the prevalence of arthritis and selected musculoskeletal disorders in the United States’, Arthritis Rheum, 1998, 41:778
26 Martin JA, Brown T, Heiner A et al., ‘Post-traumatic osteoarthritis. The role of accelerated chondrocyte senescence’, Biorheology, 2004, 41:479
27 Liu J, Sekiya I, Asai K et al., ‘Biosynthetic response of cultured articular chondrocytes to mechanical vibration’, Res Exp Med (Berl), 2001, 200:183
28 Takeuchi R, Saito T, Ishikawa H et al., ‘Effects of vibration and hyaluronic acid on activation of three-dimensional cultured chondrocytes’, Arthritis Rheum, 2006, 54:1897
29 Yamazaki S, Banes AJ, Weinhold PS et al., ‘Vibratory loading decreases extracellular matrix and matrix metalloproteinase gene expression in rabbit annulus cells’, Spine J, 2002, 2:415











Réactions