Les vibrations mécaniques d’Andullation sont converties en microcourants électriques
« Piézoélectricité »
Mot de remerciement
Je tiens à sincèrement remercier le professeur émérite Dr Pierre Lievens de la Vrije Universiteit Brussel pour ses précisions et son savoir très appréciés lors de la rédaction de cet article.
Les vibrations mécaniques d’Andullation sont converties en courants électriques
Le mécanisme central de la technologie d’Andullation est la conversion de vibrations mécaniques en microcourants électriques. C’est pourquoi les vibrations d’Andullation sont essentielles pour le rétablissement et la production des fibres de collagène. Ces fibres représentent entre 30 et 40% des protéines du corps et constituent la majeure partie des tissus conjonctifs des os, articulations, muscles et tendons.
Découverte de la piézoélectricité par Pierre et Paul-Jacques Curie
Vers 1880, les frères Curie ont découvert le phénomène de piézoélectricité. Ils ont notamment démontré qu’un cristal de quartz, sous pression mécanique et autres forces de contraction et d’expansion, subit une déformation (= sigma[σ]). Cette altération engendre l’apparition d’une tension électrique qui se traduit par des courants électriques (= intensité I). Tous les appareils, substances et molécules qui transforment les tensions mécaniques en courants électriques sont appelés « éléments piézoélectriques »1, 2. « Piézo » vient du grec « πιέζω », qui signifie « exercer une pression ».
Les matériaux piézoélectriques constituent d’excellents détecteurs
Les matériaux piézoélectriques, capables de convertir l’énergie mécanique en électricité et inversement, ne sont pas seulement indispensables dans le monde des télécoms, mais aussi dans celui de la médecine, par exemple pour l’imagerie médicale. Notamment pour les imageries par ultrasons utilisées afin de suivre l’évolution des grossesses, des appareils très avancés, tels que des transducteurs et des détecteurs nécessitant des propriétés piézoélectriques très élevées3, 4, 5, 6. À des fins commerciales cette fois, nous produisons des cristaux ferroélectriques – portant le nom savant de «cristaux de pérovskite ».
Les protéines de collagène sont d’excellents détecteurs piézoélectriques
Dans le corps humain, les fibres de collagènes sont les principaux éléments qui convertissent les vibrations mécaniques en potentiels électriques. La production de ces fibres de collagène dépend d’ailleurs à 80% du phénomène piézoélectrique. Ce phénomène a lieu en permanence, car le corps est continuellement soumis à toutes sortes de forces. La gravité, les mouvements quotidiens et les efforts physiques produisent constamment des effets piézoélectriques. Les vibrations d’Andullation peuvent elles aussi engendrer ces effets. Lors d’une séance d’Andullation, les fibres de collagène présentes dans les os, muscles, tendons et articulations font face à des contractions et expansions mécaniques. Ceci provoque ce qu’on appelle des potentiels électriques continus ou micro-potentiels électriques7 (Fig. 1).
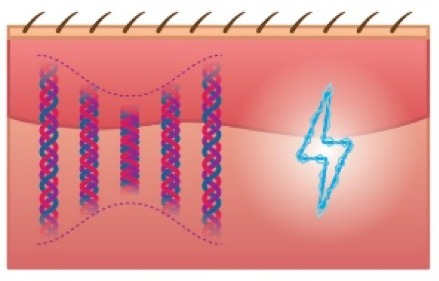
Fig. 1. Les fibres de collagène constituent le composant principal des os, cartilages, muscles et tendons. À la manière du piston d’un moteur d’une voiture qui monte et descend, les fibres de collagène sont constituées pour leur permettre de glisser l’une sur l’autre. Ces fibres possèdent des propriétés piézoélectriques. Cela signifie que l’énergie mécanique des vibrations d’Andullation compriment et étirent ces fibres, ce qui génère des microcourants électriques. Étant donné que les fibres de collagène fonctionnent comme semi-conducteurs, les microcourants générés peuvent être transmis sur de longues distances, ce qui favorise la récupération et la croissance des fibres de collagène.
Les fibres de collagène sont semi-conductrices
Les fibres de collagène sont capables de transmettre de très faibles courants électriques sur de longues distances8. Elles font donc office de semi-conducteurs. Cela explique pourquoi l’effet piézoélectrique généré permet, en combinaison avec d’autres phénomènes, une meilleure récupération et une production accélérée de fibres de collagène.
La piézoélectricité est bien connue dans le monde du sport
Les massages profonds et réguliers produisent des microcourants électriques qui répare et produise du collagène, ce qui permet une meilleure récupération face aux lésions des ligaments, des muscles, des tendons et des capsules articulaires. Les vibrations mécaniques dont les propriétés physiques sont identiques aux vibrations d’Andullation ont un effet prouvé sur le processus de guérison après une opération chirurgicale de l’articulation de l’épaule9.
La piézoélectricité stimule l’activité cellulaire
Les effets piézoélectriques des fibres de collagène modifient également le champ électrique des cellules. Pour de nombreuses autres techniques biophysiques – comparables à l’Andullation – les micropotentiels générés fournissent aux cellules de l’énergie supplémentaire afin de stimuler les fonctions cellulaires. Les cellules produisent de l’énergie (voir l’article sur l’ATP), mais ont elles-mêmes besoin d’un certain apport énergétique pour en être capable.
Les micropotentiels piézoélectriques favorisent le développement du cartilage et des os
La tension mécanique quotidienne engendrée par le mouvement actif produit l’énergie piézoélectrique nécessaire au bon fonctionnement des cellules cartilagineuses10 et osseuses11. Les vibrations microscopiques quotidiennes – non perceptibles – sont essentielles afin d’entretenir le mécanisme de glissement entre les surfaces cartilagineuses des articulations12. On sait depuis déjà longtemps que la tension mécanique des tissus osseux favorise la production énergétique (= ATP) des jeunes cellules osseuses (= ostéoblaste) et leur permet de fonctionner de façon optimale13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26.
Le prochain article concernera l’influence de l’Andullation sur la production d’énergie cellulaire.
Références
- Ranade SS, Woo SH, Dubin AE, Moshourab RA et al., ‘Piezo2 is the major transducer of mechanical forces for touch sensation in mice’, Nature, 2014, 516:121
- Liao WQ, Zhao D, Tang YY et al., ‘A molecular perovskite solid solution with piezoelectricity stronger than lead zirconate titanate’, Science, 2019, 363:1206
- Fu H, Cohen RE, ‘Polarization rotation mechanism for ultrahigh electromechanical response in single-crystal piezoelectrics Nature, 2000, 403:281
- Zhang S, Li F, Jiang X et al., ‘Advantages and challenges of relaxor-PbTiO3 ferroelectric crystals for electroacoustic transducers. A Review’, Prog Mater Sci, 2015, 68:1
- Hlinka J, ‘Doubling up piezoelectric performance. Trace amounts of samarium greatly improve materials used in sonar and ultrasound imaging’, Science, 2019, 364:228
- Li F, Cabral MJ, Xu B et al., ‘Giant piezoelectricity of Sm-doped Pb(Mg1/3Nb2/3)O3-PbTiO3 single crystals’, Science, 2019, 364:264
- Fukada E, Yasuda I, ‘Piezoelectric effects in collagen’, J Applied Physics, 1964, 3:117
- Minary-Jolandan M, Yu MF, ‘Nanoscale characterization of isolated individual type I collagen fibrils: Polarization and piezoelectricity’, Nanotechnology, 2009, 20:085706
- Dos Santos ML, Lima FPS, de Freitas STT et al., ‘Effects of vibration therapy in the musculoskeletal system in postsurgical breast cancer women: longitudinal controlled clinical study’, Research on Biomedical Engineering, 2016, 32:213
- Wolff J, ‘Das Gesetz der Transformation der Knochen‘, Hirschwald, Berlin 1892
- Fukada E, Yasuda I, ‘On the piezoelectric effect of bone’, J Physical Society Japan, 1957, 12:1158
- Adams MA, Bogduk N, Burton K, Dolan P, ‘The biomechanics of back pain. Third edition’, Churchill Livingstone, Elsevier, 2013:124
- Reich KM, Gay CV, Frangos JA, ‘Fluid shear stress as a mediator of osteoblast cyclic adenosine monophosphate production’, J Cell Physiol, 1990, 143:100
- Klein-Nulend J, Van der Plas A, Semeins CM et al., ‘Sensitivity of osteocytes to biomechanical stress in vitro’, FASEB J, 1995, 9:441
- Burger EH, Klein-Nulend J, ‘Mechanotransduction in bone. Role of the lacuno-canalicular network’, FASEB J, 1999, 13:S101
- Bakker AD, Klein-Nulend J, Tanck E et al., ‘Different responsiveness to mechanical stress in bone cells from osteoporotic versus osteoarthritic donors’, Osteoporos Int, 2006, 17:827
- Bacabac RG, Smit TH, van Loon JJWA et al., ‘Bone cell response to high-frequency vibration stress. Does the nucleus oscillate within the cytoplasm?’, FASEB J, 2006, 20:858
- Tjabringa GS, Vezeridis PS, Zandieh-Doulabi B et al., ‘Polyamines modulate nitric oxide production and COX-2 gene expression in response to mechanical loading in human adipose tissue-derived mesenchymal stem cells’, Stem Cells, 2006, 24:2262
- Vatsa A, Mizuno D, Smit TH et al., ‘Bio imaging of intracellular nitric oxide production in single bone cells after mechanical stimulation’, J Bone Miner Res, 2006, 21:1722
- Tan SD, de Vries TJ, Kuijpers-Jagtman AM et al., ‘Osteocytes subjected to fluid flow inhibit osteoclast formation and bone resorption’, Bone, 2007, 41:745
- Bacabac RG, Mizuno D, Vatsa A et al., ‘Round versus flat. Bone cell morphology, elasticity, and mechanosensing. A Perren Award winning paper’, J Biomech, 2008, 41:1590
- Vatsa A, Breuls RG, Semeins CM et al., ‘Osteocyte morphology in fibula and calvaria – is there a role for mechanosensing?’, Bone 2008, 43:452
- Bakker AD, Da Silva VC, Krishnan R et al., ‘Tumor necrosis factor alpha and interleukin-1beta modulate calcium and nitric oxide signaling in mechanically stimulated osteocytes’, Arthritis Rheum, 2009, 60:3336
- Knippenberg M, Helder MN, Bank RA et al., ‘Differential effects of bone morphogenetic protein 2 and transforming growth factor-?1 on gene expression of collagen modifying enzymes in human adipose tissue-derived mesenchymal stem cells’, Tissue Eng Part A, 2009, 15:2213
- Santos A, Bakker AD, Zandieh-Doulabi B et al., ‘Pulsating fluid flow modulates gene expression of proteins involved in Wnt signaling pathways in osteocytes’, J Orthop Res, 2009, 27:1280
- Van Hove RP, Nolte PA, Vatsa A et al., ‘Osteocyte morphology in human tibiae of different bone pathologies with different bone mineral density – is there a role for mechanosensing?’, Bone, 2009, 45:321
- de Haas WG, Watson J, Morrison DM, ‘Non-invasive treatment of ununited fractures of the tibia using electrical stimulation’, J Bone Joint Surg, 1980, 62B:465
* Guy Declerck, MD .
1964, Grieks-Latijnse Humaniora
1978, Dokter in de Genees-,Heel-, en Verloskunde (KUL)
1983, Medische Specialist in de Orthopedie (KUL & Exeter, UK)
1988, Postgraduate Orthopedic Surgery (Plymouth & Liverpool, UK)
1989, Spinal Fellow in Adult Spinal Surgery (Perth, Australia) . 1989, Research Fellow in Spinal Injuries & Rehabilitation (Perth, Australia)
1989, Neuromuscular Foundation of Western Australia Postgraduate Studentship . 1992, Spinaal Orthopedisch Chirurg (Vlaanderen en buitenland)
1992, Medical Doctor National Belgian Judo Team
1993, European Spine Research Fellowship ‘Bionic Walking’ (Stoke-on-Trent, UK)
1994, Worldwide Encyclopaedia Invited Surgeon and SAFIR Spinal Travel Fellowship
2003, Rugchirurg-op-rust in Vlaanderen
2003-2006, Sabbatical
2007-2014, International Spinal Research, Spinal Scientific Advisory Consultant & Instructor
2007-now, Consultant Research & Development Innovative & Restorative Spinal Technologies .
2007-now, Spinal Lecturing & Writing, Surgical Education (www.guy-declerck.com en www.hhp.be/nl/blog) .
2012-now: President International Association Andullation Therapy (www.iaat.eu/Science)










